
科目: 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 增大压强
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 ( )
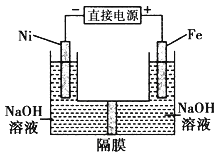
A.铁是阳极,电极反应为 Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜, 则电解结束后左侧溶液中含有FeO42-
D.电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实能用化学平衡移动原理来解释的是( )
A.加入催化剂,使N2和H2在一定条件下转化为NH3
B.将FeS2矿石粉碎更有利于焙烧制备SO2气体
C.对于反应2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深
H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深
D.用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】常温条件下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe3+、Cl-、NO3-
D.![]() =10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目: 来源: 题型:
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
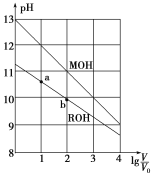
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在碘水中加入KI发生如下反应:I2(aq)+I(aq)![]() I3-(aq)(aq表示水溶液)。某I2、KI混合溶液中,c(I3-)在不同温度下的平衡平衡浓度与温度T的关系如图曲线所示。下列说法不正确的是
I3-(aq)(aq表示水溶液)。某I2、KI混合溶液中,c(I3-)在不同温度下的平衡平衡浓度与温度T的关系如图曲线所示。下列说法不正确的是
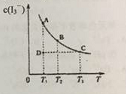
A.反应I2(aq)+I(aq) ![]() I3-(aq) 是放热反应
I3-(aq) 是放热反应
B.压强变化对该平衡影响不大
C.状态D时,v正<v逆
D.状态A与状态B相比,状态A的c(I2) 小
查看答案和解析>>
科目: 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如图:
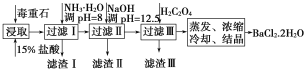
(1)毒重石用盐酸浸取前需充分研磨,目的是__。
(2)加入NH3·H2O调pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。加入H2C2O4时应避免过量,原因是__。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的__(填“上方”或“下方”)。BaCl2溶液的浓度为__mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将__(填“偏大”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知![]() 在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
pH范围 |
|
|
产物 |
| NO、 |
下列有关说法错误的是![]()
A.碱性条件下,![]() 与NaClO反应的离子方程式为
与NaClO反应的离子方程式为![]()
B.向冷的![]() 溶液中通入
溶液中通入![]() 可得到
可得到![]()
C.向冷的![]() 溶液中加入稀硫酸可得到
溶液中加入稀硫酸可得到![]()
D.向冷的![]() 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)维生素C的结构简式是___,它的分子式是____。由于它能防治坏血病,又称为____。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有____性;在维生素C溶液中滴入少量酸性KMnO4溶液,可观察到的现象是____,说明维生素C具有____性。
(2)室内空气污染物包括CO、CO2、HCHO(甲醛)、C6H6(苯)等,在这四种污染物中,由家用燃料燃烧产生的是____;由建筑和装修产生的是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】对已经达到平衡的下列体系,只改变一个条件,对平衡移动的方向判断错误的是
A.CaCO3(s) ![]() CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
B.4NH3(g) +5O2(g) ![]() 4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
C.HS- + H2O ![]() H3O + S2- ,加水稀释,平衡向逆反应方向移动
H3O + S2- ,加水稀释,平衡向逆反应方向移动
D.H2(g) + I2(g) ![]() 2HI(g) :扩大容器体积,平衡不移动
2HI(g) :扩大容器体积,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com