
科目: 来源: 题型:
【题目】把18.0 mol·L-1的浓硫酸稀释成1.80 mol·L-1的稀硫酸100 mL,实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用量筒量取________ mL的18.0 mol·L-1的浓硫酸;
②将__________沿烧杯内壁慢慢注入盛有少量__________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入________ mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线__________处;
⑥改用__________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(2)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__________;
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂为了综合利用生产过程中生成的CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:

下列有关说法错误的是
A. 将滤液蒸干,即可提取产品(NH4)2SO4
B. 通入足量氨气使悬浊液呈碱性有利于CO2的吸收
C. 副产品是生石灰,X是CO2,其中CO2可循环利用
D. 沉淀池中发生的主要反应为CaSO4+CO2+2NH3+H2O![]() CaCO3↓+(NH4)2SO4,
CaCO3↓+(NH4)2SO4,
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
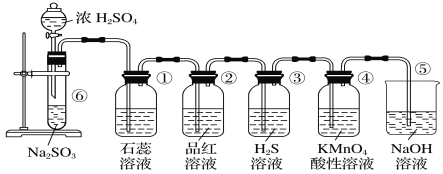
(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
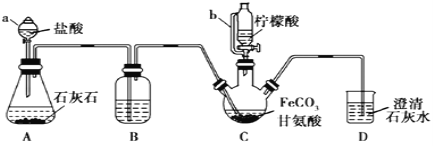
查阅资料已知:①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。实验过程如下:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是_________;与a相比,仪器b的优点是_________。
(2)装置B中盛有的试剂是:________;
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_____。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是_________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗作各种有益的探究;氨在工业上有广泛用途。
(1)合成氨用的H2可以CH4为原料制得。已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 351 | 1076 | 463 | 413 |
则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式__________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是___。
(3)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由小到大的顺序为___。
(4)直接供氨式碱性燃料电池的电池反应式4NH3+3O2=2N2+6H2O,负极电极反应式为___。
(5)如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
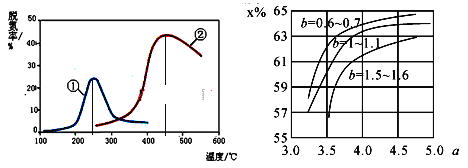
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的表达式KP=_______。
②以下说法正确的是_________。
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)15.6gNa2X中含Na+0.4mol,则Na2X的摩尔质量是________。
(2)设NA为阿伏加德罗常数的数值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是_______(用含NA的式子表示)。
(3)某溶液由Mg2+、Al3+、Cl-、SO42-四种离子组成,测得其中Al3+、SO42-、Cl-的物质的量浓度之比为3:1:13,则溶液中Mg2+、Al3+、SO42-的物质的量浓度之比为___。
(4)奥运金牌“金镶玉”环形碧玉由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则其用氧化物的形式可表示为_______。
(5)下列各项与胶体性质无关的有________。
①卤水点豆腐 ②明矾净水 ③静电除尘 ④油水分离 ⑤血液透析 ⑥三角洲形成 ⑦酸碱中和 ⑧雨后彩虹和海市蜃楼 ⑨臭氧消毒
(6)CaH2的电子式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】橡皮筋在拉伸和收缩状态时结构如图,在其拉伸过程中有放热现象。25℃、101kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )
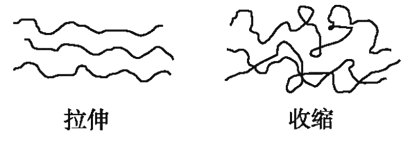
A. CaCO3=CaO+CO2↑
B. NaOH的溶解
C. 2H2+O2=2H2O
D. Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体的体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①__________;
②__________;
③__________。
(2)上述过程中发生反应的化学方程式有__________。
(3)最终试管中剩余的气体是__________,体积为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
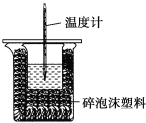
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com