
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
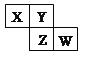
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,Z单质的熔、沸点最低
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物是形成酸雨、水体富营养化、光化学烟雾等环境问题的主要原因。
已知:反应Ⅰ.2NO(g)+O2(g)![]() 2NO2(g) ΔH1=-112 kJ/mol;
2NO2(g) ΔH1=-112 kJ/mol;
反应Ⅱ.2NO2(g)![]() N2O4(g) ΔH2=-24.2 kJ/mol;
N2O4(g) ΔH2=-24.2 kJ/mol;
反应Ⅲ.3O2(g)![]() 2O3(g) ΔH3=+144.6 kJ/mol;
2O3(g) ΔH3=+144.6 kJ/mol;
(1)大气层中O3氧化NO的热化学方程式为3NO(g)+O3(g)![]() 3NO2(g) ΔH4=________。
3NO2(g) ΔH4=________。
(2)某温度下,向1L刚性容器中投入1mol O2发生反应Ⅲ,5min时压强变为原来的0.9倍后不再变化。
①5min内O3的生成速率v(O3)=______________________。
②平衡时O2的转化率α(O2)________30%(填“>”“=”或“<”)。
(3)常温下,向压强为pkPa的恒压容器中充入2molNO和1molO2,发生反应Ⅰ和反应Ⅱ。平衡时NO和NO2的物质的量分别为0.2mol和1mol,则常温下反应Ⅱ的平衡常数Kp=____________kPa-1(已知气体中某成分的分压p(分)=![]() ×p(总),用含p的式子表示)。
×p(总),用含p的式子表示)。
(4)工业上常用氨气去除一氧化氮的污染,反应原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+
5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+![]() (T为开氏温度)。
(T为开氏温度)。
①该反应ΔH_______________0(填“>”“=”或“<”)。

②一定温度下,按进料比n(NH3)∶n(NO)=1∶1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是______________________;当反应温度高于380 ℃时,NO的去除率迅速下降的原因可能是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3)是合成其它含钴配合物的重要原料。制备流程如下:
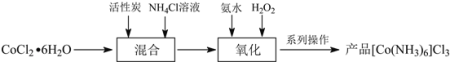
(1) “混合”步骤需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸的目的是______。
(2)流程中加入![]() 溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
(3)“氧化”步骤中应先加入氨水再加入![]() ,理由是______。
,理由是______。
(4)为测定产品中钴的含量,进行下列实验:
①称取样品4.000g于烧瓶中,加80mL水溶解,加入15.00mL 4molL-1NaOH溶液,加热至沸15~20min,冷却后加入15.00mL 6molL-1HCl溶液酸化,将![]() 转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
②加入足量KI晶体,充分反应;
③![]() 加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验分析错误的是![]()
A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列物质的电子式:
NH4Cl_______________ NaOH__________________
H2O2_________________ HClO_________________
(2)已知有下列物质:①HNO3 ②硫单质 ③NaOH ④液氦 ⑤Na2O2 ⑥H2O2 ⑦CCl4 ⑧NH4Cl ⑨KBr ⑩O2,分别将正确的序号填入相应的位置。
以上物质中只含有离子键的是______________;
只含有共价键的是__________________;
既含有离子键又含有共价键的是____________;
含有非极性共价键的化合物是________;
不含化学键的是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
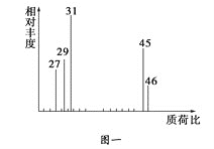

(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素的常见化合价与原子序数的关系图:
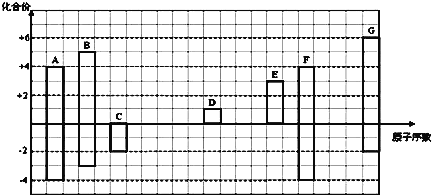
注:答题时,A—G所有元素都用其对应的元素符号表示。
(1)画出A的原子结构示意图______________;
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物(H的稳定氧化物为液态)时放出的热量为QkJ,请写出表示1molA2H6完全燃烧的热化学方程式:_____________;
(3)用电子式表示D2G的形成过程______________;其所含化学键类型为________;
(4)C2-、D+、G2-离子半径大小顺序是___>____>____;
(5)C、G元素所形成的氢化物稳定性为___>____(填化学式),原因是:______________;
(6)某同学设计实验证明A、B、F的非金属性强弱关系, 装置如图。
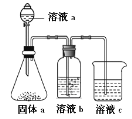
①溶液a和b分别为_________,__________;
②溶液c中发生反应的离子方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生活中有广泛应用。
(1)Fe3+基态核外电子排布式为______。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为______。
②类卤素离子![]() 可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸
可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() ,这两种酸中沸点较高的是______
,这两种酸中沸点较高的是______
(3)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为______。

(4)某铁的化合物结构简式如图2所示
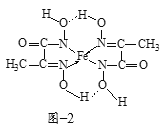
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)![]() 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g)![]() 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g)![]() 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______kJ·mol-1 。
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______。

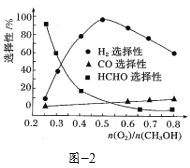
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中![]() 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制![]() =______,当
=______,当![]() = 0.25时,CH3OH和O2发生的主要反应方程式为______。
= 0.25时,CH3OH和O2发生的主要反应方程式为______。
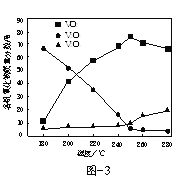
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______。
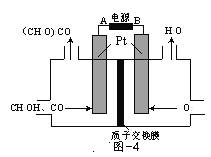
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______(填“A”或“B”)。
②阳极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究__________________元素性质递变规律。
(2)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液、酚酞溶液等。
仪器:______、______、滤纸、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) | __ | __ | __ | __ | __ | __ |
①__________________________________________________;
②___________________________________________________;
此实验的结论:__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com