
科目: 来源: 题型:
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
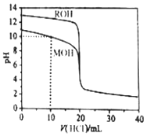
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该物质的说法正确的是( )![]()

A.该物质的分子式为C16H18O3
B.该物质分子中的所有原子可能共平面
C.滴入KMnO4溶液,可观察到紫色褪去,证明结构中存在碳碳双键
D.1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol、7 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,装置连接好后,电流计指针发生了偏转,下列说法中正确的是

A.两个番茄及相关电极均构成了原电池
B.锌是负极
C.电子移动:锌→铜(右)→番茄→石墨→铜(左)
D.两个铜片上均发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B___;C___。
(2)写出D元素在周期表中的位置___。
(3)用电子式表示C2D的形成过程:___。
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式___;属于___(填“离子”或“共价”)化合物,存在的化学键的种类有___;写出它与水反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物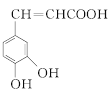 是一种重要的有机合成中间体,其合成路线如下:
是一种重要的有机合成中间体,其合成路线如下:
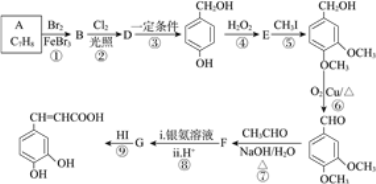
已知:①B的核磁共振氢谱有三个吸收峰;
②![]()
![]()
 ;
;
③
![]()
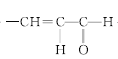 +H2O 。
+H2O 。
(1)B的名称为____________。
(2)反应⑤的反应类型为__________。G的结构简式为_______________。
(3)在合成路线中设计⑤和⑨两步反应的目的是________________。
(4)反应⑥的化学方程式为__________________。
(5)F与银氨溶液反应的化学方程式为________________。
(6)M为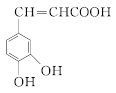 的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
a.属于芳香族化合物 b.1 mol M与足量NaHCO3溶液反应能生成2 mol CO2
(7)参照上述合成路线,以乙醇为原料(其他无机试剂任选),设计制备正丁醇的合成路线_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置 (夹持装置已略)如图所示:下列说法错误的是( )
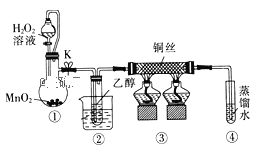
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出,再停止加热
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲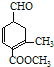 、乙
、乙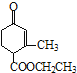 两种有机物,下列说法中不正确的是( )
两种有机物,下列说法中不正确的是( )
A.可用新制的氢氧化铜悬浊液区分这两种有机物
B.甲、乙互为同分异构体
C.甲在酸性和碱性条件下都能发生水解反应
D.等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.乙烯、SO2能使酸性高锰酸钾溶液褪色,其褪色原理相同
B.CO和H2混合气体和氧气中充分燃烧,只要混合气体总物质的量一定,消耗氧气的量一定
C.乙醛在一定条件下能与氢气反应生成乙醇,发生了还原反应
D.CH2=CH2+HCl![]() CH3CH2Cl该有机反应应为取代反应
CH3CH2Cl该有机反应应为取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是临床常用的镇静、麻醉药物,其合成路线流程图如下:
(1)B中的含氧官能团名称为______和______。
(2)D→E的反应类型为______。
(3)X的分子式为C5H11Br,写出X的结构简式:______。
(4)F→G的转化过程中,还有可能生成一种高分子副产物Y,Y的结构简式为______。
(5)写出同时满足下列条件的G的一种同分异构体的结构简式:______。
①分子中含有苯环,能与FeCl3溶液发生显色反应
②分子中只有4种不同化学环境的氢
(6)写出以CH2BrCH2CH2Br、CH3OH和CH3ONa为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
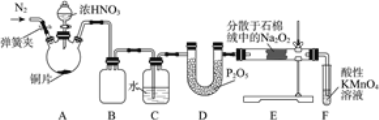
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com