
科目: 来源: 题型:
【题目】己知常温下CH3COOH的电离常数为K,该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示。下列说法不正确的是( )
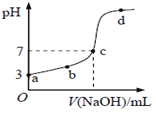
A. c点表示CH3COOH和NaOH恰好完全反应
B. b点表示的溶液中c (CH3COO-)>c(Na+)
C. a点表示的溶液中c (CH3COO-)略小于10-3mo1/L
D. b、d点表示的溶液中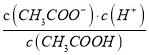 均等于K
均等于K
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
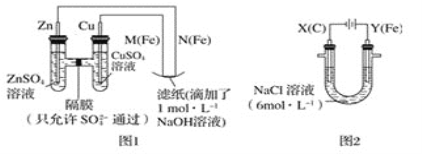
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是___(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为___。
(3)实验过程中,SO42-___(填“从左向右”,“从右向左”或“不”)移动;滤纸上能观察到的现象有:___。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH___(填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应之一为Fe﹣6e-+8OH-=FeO42-+4H2O,若在X极收集到784mL气体,在Y极收集到112mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)F2通入稀NaOH溶液中可生成OF2,OF2立体构型为___,其中氧原子的杂化方式为___。
(2)X、Y、Z、R为前四周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。XY2-的立体构型是___;X与Z形成化合物中含有的化学键是___、R2+的水合离子中,提供孤电子对的原子是___。
(3)ClO3-的立体构型为___(用文字描述,下同);CO32-的立体构型是__。
(4)在BF3分子中:F—B—F的键角是___,B原子的杂化轨道类型为__,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___。
(5)用价层电子对互斥理论推断,SnBr2分子中Sn—Br键的键角___(填“>”“<”或“=”)120°。其原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/ c(CO2)·c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为负值 B. 恒温恒容下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小 D. 该反应的化学方程式为CO2+H2 ![]() CO+H2O
CO+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氧和硫的化合物在化工生产上应用非常广泛.试回答下列问题:
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。
己知:6Ag(s)+O3(g)═3Ag2O(s);△H=﹣235kJ/mol;
2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
则反应2O3(g)=3O2(g)的△H=___。
(2)SO2Cl2常用于制造医药品、染料、表面活性剂等.已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
(3)对(2)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图所示。

①0~20min反应的平均速率v(SO2Cl2)=___。△H___0(填“<”“>”或“=”)其原因是:___。
②下列叙述正确的是___。
A.A点v正(SO2Cl2)>v逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析错误的是( )
A.镓元素为第四周期第ⅢA元素
B.原子半径:Br>Ga
C.79Br与81Br得电子能力相同
D.碱性:Ga(OH)3>Al(OH)3,酸性:HClO4>HBrO4
查看答案和解析>>
科目: 来源: 题型:
【题目】类推法在化学学习过程中广泛使用,如下四项推测,其中正确的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据结构和组成相似的物质,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3
C.CO2中的C采用sp杂化轨道成键,CS2中的C也是采用sp杂化轨道成键
D.CH4的空间结构为正四面体,键角为109°28′,P4的空间结构也为正四面体,键角为109°28′
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
HF(aq)+OH—(aq)=F—(aq)+H2O(l)△H=—67.7 kJ·mol—1
②H+(aq)+OH—(aq)=H2O(l)△H=—57.3 kJ·mol—1
在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A. 氢氟酸的电离方程式及热效应可表示为HF(aq)=H+(aq) +F(aq) △H=+10.4kJ·mol—1
B. 当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C. 当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D. 当V>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________________。
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
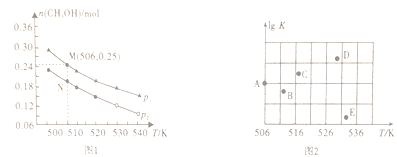
①该反应的△H_____0(填“>”、“<”或“=”),判断理由是_______________。
②M点时,CO的转化率为________。506K时该反应的平衡常数K=________(保留三位小数)。
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为____________。
④下列叙述能说明反应CO(g)+2H2(g) ![]() CH3OH(g)达到平衡状态的是________(填序号)。
CH3OH(g)达到平衡状态的是________(填序号)。
A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com