
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有2个电子。
(1)F2+离子的电子排布式是_______________。
(2)B、C、D三种元素的电负性由大到小的顺序为___________________________
(3)B、C元素的某些氢化物的分子中均含有18个电子, B、C的这些氢化物的沸点相差较大的主要原因是________________________________________________。
(4)D、E可形成ED32-,则该离子的立体构型为____________;A、B、D可形成A2B2D4分子,1mol该物质能与2molNaHCO3反应,则1 mol该分子中含有π键的数目为________。
(5)如图表示F与E形成的化合物晶胞(黑球是F、白球是E),该化合物的化学式为________;该晶胞边长为540.0 pm,该晶体密度为____________g·cm-3

查看答案和解析>>
科目: 来源: 题型:
【题目】钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )
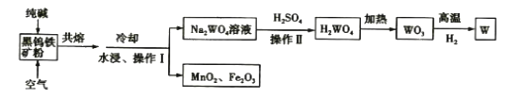
A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(II)和Mn(II)
C.操作II是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )

结合实验,下列说法不正确的是( )
A.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B.①中溶液橙色加深,③中溶液变黄
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.②中Cr2O72-被C2H5OH还原
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是
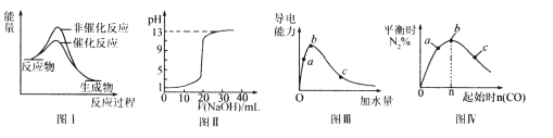
A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.100 mol/L NaOH溶液滴定20.00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
科目: 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子排布式为_________________。钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是______________,VO43-的立体构型为__________。
(2)2-巯基烟酸氧钒配合物(图1)是副作用较小的有效调节血糖的新型药物。

①该药物中N原子的杂化方式是____________,其所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
②2-巯基烟酸(图2)水溶性优于2-疏基烟酸氧钒配合物的原因是_________________________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,图4为该晶胞的俯视图,该晶胞的密度为________________ g·cm-3(列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是

A. 图中五点Kw间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量酸的方法
C. 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D. 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值。下列说法正确的是
A.1 L0.5 mol/L Na2SO3溶液中含氧原子数为1.5NA
B.1 mol Na2O2中阴阳离子总数为3NA
C.4.6 g NO2和N2O4混合气体中含氧原子数为0.3NA
D.11.2 L NH3所含的分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是
A.硝酸铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+↑+2H2O
B.用铝粉和NaOH溶液反应制取大量H2:Al+2OH-=AlO2-+H2↑
C.实验室制取Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.氯气溶于水,与水的反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验、现象及相关结论均正确的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30s不复原 | 出现白色沉淀 |
结论 | SO2 有强强氧化性 | 有机物中含有溴原子 | 滴定达终点 | Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com