
科目: 来源: 题型:
【题目】沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭。
(1)建立沼气池可实现如图能量转化:___、___(在框内填写能量的形式)。
![]()
(2)在101kPa时,32gCH4燃烧生成CO2和气态H2O,放出1604kJ的热量,写出甲烷燃烧的热化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中:
①液氯②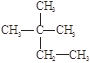 ③白磷④氯气⑤
③白磷④氯气⑤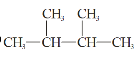 ⑥
⑥![]() Cl⑦
Cl⑦![]() Cl⑧红磷⑨氢氧化钠⑩氩
Cl⑧红磷⑨氢氧化钠⑩氩
(1)互为同分异构体的有___;
(2)互为同素异形体的有___;
(3)属于同位素的有___;
(4)属于同一种物质的有___;
(5)晶体中不含化学键的是___。(填序号)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验事实得出的相应结论正确的是( )
选项 | 实验事实 | 结论 |
A | NH3 的水溶液可以导电 | NH3 是电解质 |
B | SO2 通入硝酸钡溶液出现白色沉淀 | BaSO3 不溶于强酸 |
C | 浓硝酸久置发黄 | 硝酸不稳定 |
D | 浓硫酸能脱去胆矾晶体中的水 | 浓硫酸具有脱水性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
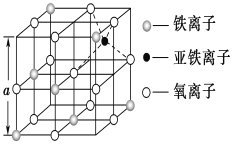
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】全球碳计划组织(GCP,The Global Carbon Project)报告称,2018年全球碳排放量约371亿吨,达到历史新高。
(1)中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图1所示。

①已知:CO2(g)+H2(g)=CO(g)+H2O(g) △H= + 41 kJ·mol-1
2CO2(g)+6H2(g)=4H2O(g)+CH2=CH2(g) △H= -128 kJ·mol-1
则上述过程中CO和H2转化为CH2=CH2的热化学方程式是_________。
②下列有关CO2转化为汽油的说法,正确的是___________________(填标号)。
A. 该过程中,CO2转化为汽油的转化率高达78%
B. 中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C. 在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
D. 催化剂HZSM-5可以提高汽油中芳香烃的平衡产率
③若在一容器中充入一定量的CO2和H2,加入催化剂恰好完全反应,且产物只生成C5以上的烷烃类物质和水。则起始时CO2和H2的物质的量之比不低于_________。
(2)研究表明,CO2和H2在一定条件下可以合成甲醇。反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
①该反应自发进行的条件是__________(填“高温”“低温”或“任意温度”)
②催化效果最佳的催化剂是__________(填“A”“B”或“C”);b点时,![]() ________
________![]() (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③若容器容积保持不变,则不能说明该反应达到化学平衡状态的是________。
a.c(CO2)与c(H2)的比值保持不变
b.v(CO2)正=v(H2O)逆
c.体系的压强不再发生变化
d.混合气体的密度不变
e.有lmolCO2生成的同时有断开3mol的H-H键
f.气体的平均相对分子质量不变
④已知容器内的起始压强为100 kPa,若图2中c点已达到平衡状态,则该温度下反应的平衡常数Kp =____________________(只列出计算式,不要求化简,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与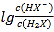 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置,将溶液 A 逐渐加入固体 B 中,下列叙述中不正确的是( )
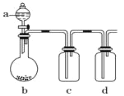
A.若 a 为浓盐酸,b 为 MnO2,c 中盛品红溶液,则 c 中溶液不褪色
B.若 a 为稀硫酸,b 为 FeS,c 中盛硫酸铜溶液,则 c 中产生淡黄色沉淀
C.若 a 为醋酸溶液,b 为贝壳,c 中盛过量澄清石灰水,则 c 中溶液变浑浊
D.若 a 为浓氨水,b 为生石灰,c 中盛 AlCl3 溶液,则 c 中产生白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com