
科目: 来源: 题型:
【题目】工业上可由天然气为原料制备甲醇,也可由水煤气合成甲醇.
![]() 已知:
已知:![]() ,
,![]() ,
,![]() 。试写出由
。试写出由![]() 和
和![]() 制取甲醇的热化学方程式:______;
制取甲醇的热化学方程式:______;
![]() 通过下列反应制备甲醇:
通过下列反应制备甲醇:![]() ,图甲是反应时
,图甲是反应时![]() 和
和![]() 的浓度随时间t的变化情况,从反应开始到平衡,用
的浓度随时间t的变化情况,从反应开始到平衡,用![]() 表示平均反应速率
表示平均反应速率![]() ______,平衡时CO的转化______.
______,平衡时CO的转化______.
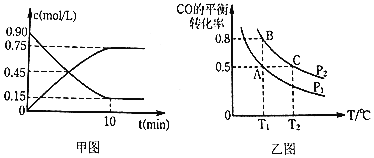
![]() 在一容积可变的密闭容器中充入
在一容积可变的密闭容器中充入![]() 和
和![]() ,CO的平衡转化率随温度
,CO的平衡转化率随温度![]() 、压强
、压强![]() 的变化如图乙所示.
的变化如图乙所示.
![]() 下列说法不能判断该反应达到化学平衡状态的是______
下列说法不能判断该反应达到化学平衡状态的是______![]() 填字母
填字母![]()
A ![]() 的消耗速率等于
的消耗速率等于![]() 的生成速率的2倍
的生成速率的2倍
B ![]() 的体积分数不再改变
的体积分数不再改变
C 体系中![]() 的转化率和CO的转化率相等
的转化率和CO的转化率相等
D 体系中气体的平均摩尔质量不再改变
![]() 比较A、B两点压强大小
比较A、B两点压强大小![]() ______
______![]() 填“
填“![]() 、
、![]() 、
、![]() ”
”![]()
![]() 若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入
若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入![]() 和
和![]() 2,则在平衡状态B时,容器的体积
2,则在平衡状态B时,容器的体积![]() ______L;
______L;
![]() 以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]()
![]() 若KOH溶液足量,则电池负极反应的离子方程式为______;
若KOH溶液足量,则电池负极反应的离子方程式为______;
![]() 若电解质溶液中KOH的物质的量为
若电解质溶液中KOH的物质的量为![]() ,当有
,当有![]() 甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2含有较多的MnO和MnCO3样品转化为纯MnO2实验,其流程如图:
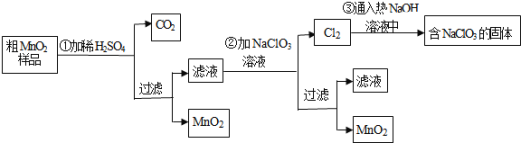
![]() 第
第![]() 步加稀H2SO4时,粗MnO2样品中的MnO和______
步加稀H2SO4时,粗MnO2样品中的MnO和______![]() 写化学式
写化学式![]() 转化为可溶性物质.
转化为可溶性物质.
![]() 完成第
完成第![]() 步反应的离子方程式:
步反应的离子方程式:
______ ______+_____ClO3-+ _____Mn2+=______MnO2+______Cl2↑+______ ______
![]() 过滤操作必需的玻璃仪器有______、______、______,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有______
过滤操作必需的玻璃仪器有______、______、______,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有______![]() 写名称
写名称![]() .
.
![]() 若粗MnO2样品的质量为25.38g,第
若粗MnO2样品的质量为25.38g,第![]() 步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则在第
步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则在第![]() 步反应中至少需要______mol NaClO3 .
步反应中至少需要______mol NaClO3 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
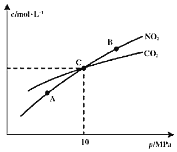
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
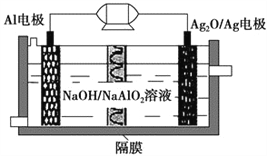
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.1 mol
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目: 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
D.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
X | Y | Z | |
W |
(1)X元素在元素周期表中的位置_____________________.
(2)X 、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为____________.
(3)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为______.
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器______![]() 填“能”或“不能”
填“能”或“不能”![]() 用来腌制咸菜,原因是______.
用来腌制咸菜,原因是______.
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇![]() 氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______
氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______![]() 关于该电池的下列说法,正确的是______
关于该电池的下列说法,正确的是______
A 工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B 工作时电流由电极a通过传感器流向电极b
C 传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:____________![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]()

查看答案和解析>>
科目: 来源: 题型:
【题目】单质硫在NaOH的热浓溶液中发生歧化反应,将2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,再加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4。计算:(1)a/b=________;
(2)V至少为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 若正反应是放热反应,则A为气态
C. 物质A一定为非气态,且正反应是吸热反应
D. 若向容器中充入惰性气体,则平衡向右移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:![]() +HNO3
+HNO3![]()
![]()
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com