
科目: 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如图所示,下列说法正确的是( )
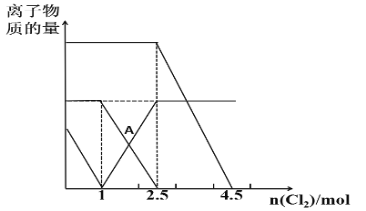
A.三种离子的还原性强弱关系是:Br->Fe2+>I-
B.A点表示Fe2+正好反应了一半
C.原溶液中:n(Fe2+)︰n(I-)︰n(Br-)=2︰1︰3
D.当通入2.5molCl2时,溶液中已发生的离子反应可表示为:6Fe2++4I-+5Cl2=6Fe3++2I2+10Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a
B. 常温下0.1 molL-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A)
C. 室温时 M(OH)2(s)![]() M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +
M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +![]() 1g
1g![]()
D. 0.1 molL-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求答题:
(l)食品和药物安全是国家高度重视的民生问题。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______;
②是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______;
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______。
(2)钢铁是目前用量最大、用途最广的合金材料,在潮湿空气中容易发生腐蚀。请写出钢铁发生电化学腐蚀的负极反应式_______________________________________。
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料, 生活中的玻璃、陶瓷、水泥属于上述材料中的______________,
查看答案和解析>>
科目: 来源: 题型:
【题目】据报导,我国已研制出“可充室温钠—二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时吸收CO2,充电时释放CO2
C. 放电时Na+向碳纳米管移动
D. 放电时的负极反应为2Na-2e-+CO32-=Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )
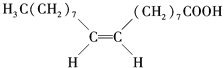
A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,反应2XY(g)![]() X2(g)+Y2(g) 达到平衡的标志是
X2(g)+Y2(g) 达到平衡的标志是
A. 单位时间内,生成nmolX2的同时,生成nmolXY
B. 单位时间内, 生成nmolX2的同时,生成nmolY2
C. 单位时间内,生成2nmolXY的同时,消耗nmolY2
D. 单位时间内,生成nmolX2的同时,消耗nmolY2
查看答案和解析>>
科目: 来源: 题型:
【题目】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________(电离度=![]() ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差在本实验的滴定过程中,下列操作会使实验结果偏大的是_________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、NH4+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol/L.往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
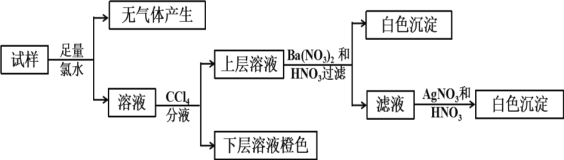
A.Ba2+、Fe3+、SO42-、CO32-肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含SO42-和SO32-
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含NH4+需另做实验判断
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() 微溶于水,可溶于硝酸。溶液X中可能含有
微溶于水,可溶于硝酸。溶液X中可能含有![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
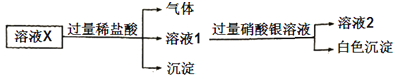
下列说法正确的是( )
A.溶液X中一定含有![]()
![]() 和
和![]()
B.溶液X中一定不含![]() 、
、![]()
C.为确定溶液X中是否含有![]() ,可取溶液2,加入
,可取溶液2,加入![]() 溶液
溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
查看答案和解析>>
科目: 来源: 题型:
【题目】已知可逆反应CO(g) + H2O (g)CO2(g) + H2(g),在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K= _______。
(2)830K时,若起始时:c (CO) = 2mol/L,c (H2O)=3mol/L,平衡时CO的转化率为60%, K值为________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为_______。
(4)若830K时起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,①a、b、c之间的关系式是_________;
②当a = b时,a= ________c。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com