
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,下列说法不正确的是( )
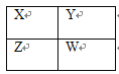
A.Y的气态氢化物的稳定性一定比W的强
B.W的原子序数可能是Y的原子序数的2倍
C.Y原子形成的简单离子半径一定比X原子形成的简单离子半径大
D.若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ca3N2遇水发生水解反应,需密封保存。利用如下装置制取氮气,并用氮气制备Ca3N2,下列说法正确的是 ( )
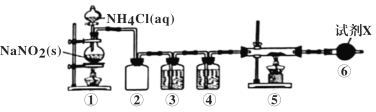
A.①中发生的反应属于置换反应
B.②的作用为安全瓶,防止停止加热时①中的溶液进入③中
C.③、④、⑥中依次盛装浓H2SO4、酸性氯化亚铁溶液、碱石灰
D.取⑤中少量产物,加适量蒸馏水,再滴加石蕊试液,溶液显蓝色
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
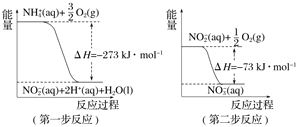
① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
② 1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是_______________________。
(aq)的热化学方程式是_______________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4) 已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1 ②
O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________。
(5) 已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,在四支相同的试管中,分别装入等物质的量混合的两种气体。混合气体具体组成如下:
试管编号 | 1 | 2 | 3 | 4 |
混合气体组成 | Cl2、SO2 | NO2、O2 | NO、O2 | NH3、N2 |
将四支试管迅速同时倒立于水槽中,至液面稳定后,水面上升高度由大到小正确的是( )
A.1>2>3>4B.3>1>4>2
C.4>2>3>1D.1>3>2>4
查看答案和解析>>
科目: 来源: 题型:
【题目】以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)![]() SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
A. 该滴定反应可以表示为:SO32-+ SO2+=2SO2
B. 在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C. 自离解的存在,说明SO2是离子化合物
D. 可通过导电能力变化来判断是否到达滴定终点
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为元素周期表的一部分,下列说法中正确的是( )

A.Z元素的最高价氧化物对应的水化物能与X的最简单气态氢化物的水溶液反应
B.X、Y、Z、W元素形成的简单离子半径由小到大的顺序为Z<X<Y<W
C.W的最简单气态氢化物的水溶液能与其最高价氧化物对应的水化物反应生成W元素对应的单质
D.X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___。
(2)在[Fe(CN)6]3-中不存在的化学键有__。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__;分子中σ键和π键数目之比为__。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是__。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
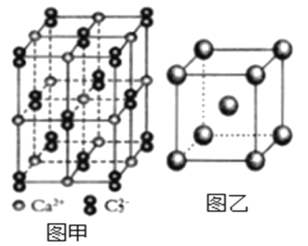
(5)与C22-互为等电子体的微粒__(写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__nm(用含有d、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、Q、R均为短周期元素(原子序数Y<X<R<Q<Z)。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol/L)的pH和原子半径的关系如图所示。下列说法中正确的是( )
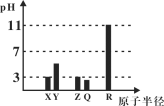
A.X和R的简单离子半径:X < R
B.Z、Q的气态氢化物的稳定性:Z > Q
C.Z的最高价氧化物对应水化物的化学式为HZO3
D.上述五种元素中有两种元素是金属元素
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于焓变![]() 的叙述或判断正确的是
的叙述或判断正确的是![]()
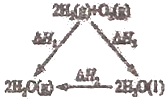
A.据如图可知:![]()
B.由![]() 可知,若将含1mol
可知,若将含1mol![]() 的稀溶液与含1molNaOH的稀溶液混合,放出的热量为
的稀溶液与含1molNaOH的稀溶液混合,放出的热量为![]()
C.![]() 、30MPa下,将
、30MPa下,将![]() 和
和![]() 置于密闭容器中充分反应,放出
置于密闭容器中充分反应,放出![]() 热量,则反应
热量,则反应![]() 的
的![]()
D.![]() 在常温下能自发进行,则该反应的
在常温下能自发进行,则该反应的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com