
科目: 来源: 题型:
【题目】已知A是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
![]() 写出A的结构简式______。
写出A的结构简式______。
![]() 、D分子中的官能团名称分别是______、______。
、D分子中的官能团名称分别是______、______。
![]() 物质B可以被直接氧化为D,需要加入的试剂是______。
物质B可以被直接氧化为D,需要加入的试剂是______。
![]() 写出下列反应的化学方程式及其反应类型。
写出下列反应的化学方程式及其反应类型。
![]() ______;反应类型:______。
______;反应类型:______。
![]() ______;反应类型:______。
______;反应类型:______。
![]() ______;反应类型:______。
______;反应类型:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
①用A表示的反应速率是0.4 mol·L-1·min-1
②在2 min末时,反应物B的反应速率是0.3 mol·L-1·min-1
③在这2 min内用C表示的平均速率为0.2 mol·L-1·min-1
④在2 min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1 mol·L-1,则2 min时D的浓度为0.3 mol·L-1
A. ①②③B. ②④C. ④⑤D. ③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-等六种微粒,其中N2的物质的量随时变化曲线如图所示,下列判断正确的是( )

A.该反应的氯元素被氧化
B.反应后溶液的酸性明显减弱
C.消耗1 mol还原剂,转移3 mol电子
D.氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
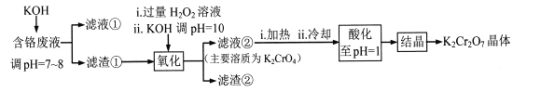
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
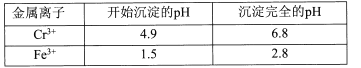
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。
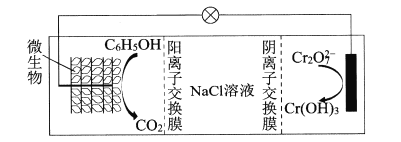
①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有二氧化硅、氧化铝等杂质。制备流程如图所示:

(1)步骤①的主要反应为:FeOCr2O3+NaOH+O2![]() Na2CrO4+Fe2O3+H2O 。
Na2CrO4+Fe2O3+H2O 。
上述反应配平后氧化剂与还原剂的系数比为__________。
若在实验室中进行步骤①,应该在_______中进行(填序号)
A.石英坩埚 B.铁制坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)滤渣1中含量最多的金属元素是__________(填元素符号);滤渣2的主要成分是_________及含硅杂质;步骤③调滤液1的pH使之变_________(填“大”或“小”)
(3)向“滤液3”中加入适量KCl,经结晶过滤得到K2Cr2O7固体。步骤⑤的反应类型是___________反应。
(4)某工厂用380 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品250 kg,产率为________×100%(保留2位有效数字,M(Cr2O3)=152g/mol;M(K2Cr2O7)=294g/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
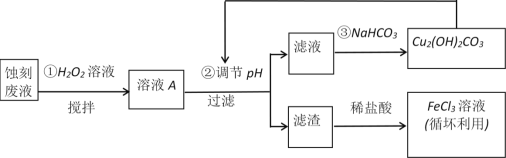
请回答:
(1)把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(2)FeCl3蚀刻液中加入盐酸的目的是______________________________。
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)_____________________。
(4)已知:生成氢氧化物沉淀的pH如下表
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是________________。
(5)上述流程路线中,除FeCl3溶液外,还可用于循坏利用的物质是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4[Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mgkgˉ1。一种制备黄血盐的工艺如下:
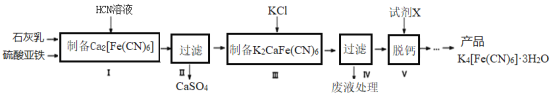
回答下列问题:
(1)步骤Ⅰ反应的化学方程式为____________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为(填化学式)___________________。
(3)步骤Ⅴ所用的试剂X是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其他七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常作为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。
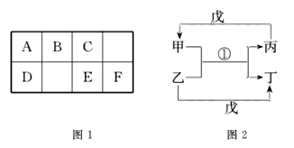
已知图2中反应①是复分解反应,生成物中水已略去。请回答下列问题:
(1)上述元素组成的单质中,硬度最大的是_________________(填该物质名称)。
(2)若戊是含有18电子的双原子分子,则丙的电子式为________________;在①中制取气体丙的化学方程式为_______________________________________________ 。
(3)若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用作干燥剂,写出甲的一种用途:_____________________________。
(4)如果图2中反应①是置换反应,戊是单质,则戊不可能是 _____________。(填序母序号)
A、O2 B、Cl2 C、H2 D、N2
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:

回答下列问题:
(1)化合物B中含氧官能团名称是_________F的结构简式__________________
(2)写出C与银氨溶液共热的化学反应方程式:_______________________
(3)化合物D不能发生的反应有__________________(填序号)。
①加成反应②取代反应③消去反应④氧化反应⑤水解反应
(4)B的含苯环结构的同分异构体还有__________种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是____________(填结构简式)。
(5)B与D发生反应的类型________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
最低化合价 | ﹣2 | ﹣3 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣1 | 0 |
已知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:____________________________________________________________;
(2)E的简单气态氢化物极易溶于水的原因有:①_____________________________;
②____________________________________________。
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_______________。
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com