
科目: 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是_______________________________。
② 氨催化氧化生成一氧化氮反应的化学方程式是_____________________________。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
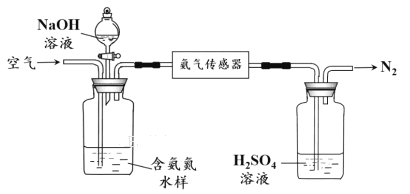
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_____________________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为_______mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
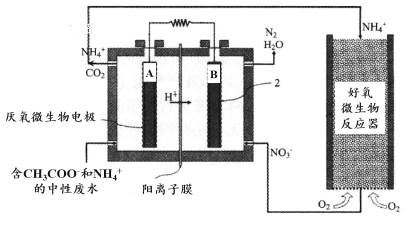
① 已知A、B两极生成CO2和N2,写出A极的电极反应式:______________________。
② 用化学用语简述NH4+去除的原理:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式______________。
(2)写出NaClO3发生反应的主要离子方程式______________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为___________。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________________。(答一条即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计实验探究构成原电池的条件,装置如图所示:
甲. 乙.
乙.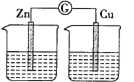
实验一:探究电极的构成。图甲中,①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③A极用锌片,B极用铜片,发现电流计指针向左偏转;④A极用锌片,B极用石墨,发现电流计指针向左偏转。
(1)结论一:________________________;
实验二:探究溶液的构成。图甲中,A极用锌片,B极用铜片,①液体采用无水乙醇,发现电流计指针不偏转;②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
(2)结论二:________________________;
实验三:探究图乙装置能否构成原电池。将锌、铜两电极分别放入稀硫酸中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
(3)结论三:________________________;
思考:对该同学的实验,有同学提出了如下疑问,请你帮助解决。
(4)在图甲装置中,若A为镁片,B为铝片,电解质溶液为![]() 溶液;负极为________(填“A”或“B”);电流计的指针应向________(填“右”或“左”)偏转。
溶液;负极为________(填“A”或“B”);电流计的指针应向________(填“右”或“左”)偏转。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
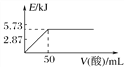
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
(1)某有机物的结构简式如图。该有机物分子是___(填“极性”或“非极性”)分子,该有机物分子中电负性最大的原子为___。

(2)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列叙述中不正确的是( )
A.16g氧气中含有的氧原子数目为NA
B.1L0.1mol·L-1Na2CO3溶液中含有的阴离子数目大于0.1NA
C.标准状况下,22.4LCl2中含有的电子数为34NA
D.标准状况下,22.4L乙醇中含有的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.25mol·L-1的NaOH溶液,分别滴定同浓度的三种稀酸溶液,滴定的曲线如图所示,下列判断不正确的是

A. 同浓度的稀酸中:c(A-)>c(B-)>c(D-)
B. 滴定至P点时,溶液中:c(B-)>c(HB)
C. pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB) +c(HD)═c(OH-)-2c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目: 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如下:

已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
回答下列问题:(1)“浸取”时,为了提高浸取速率,可采取的措施有______(任写一条);过滤1的滤渣中的某种主要成分可溶于一种弱酸,写出该反应的化学方程式______。
(2)浸取时加入过量浓盐酸的目的是______;“母液”中通入气体X后可循环利用,气体X为______(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式______。
(4)用![]() 双硫腙,二元弱酸
双硫腙,二元弱酸![]() 络合萃取法可从工业废水中提取金属离子:
络合萃取法可从工业废水中提取金属离子:![]() 先将金属离子络合成电中性的物质
先将金属离子络合成电中性的物质![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此络合物。图2是用上述方法处理含有
萃取此络合物。图2是用上述方法处理含有![]() 、
、![]() 、
、![]() 的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。

①当![]() :
:![]() :4时,废水的
:4时,废水的![]() ______。
______。
②向萃取后的![]() 中加入足量的NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___。
中加入足量的NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___。
(5)取焙烧得到的![]() 样品
样品![]() ,加入稀硫酸和
,加入稀硫酸和![]() 溶液使其完全溶解。已知
溶液使其完全溶解。已知![]() 被还原为
被还原为![]() ,
,![]() 被氧化成成
被氧化成成![]() ,试写出该反应的离子方程式:____。然后用新配制的
,试写出该反应的离子方程式:____。然后用新配制的![]() 溶液对生成的
溶液对生成的![]() 进行滴定,滴定完成后稍耗
进行滴定,滴定完成后稍耗![]() 溶液。则该样品中
溶液。则该样品中![]() 纯度为____。
纯度为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置进行实验:

若图中x轴表示流入正极的电子的物质的量,则y轴可以表示:①![]() ,②
,②![]() ,③a棒的质量,④b棒的质量,⑤溶液的质量中的( )
,③a棒的质量,④b棒的质量,⑤溶液的质量中的( )
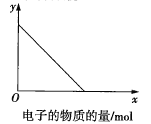
A.①③B.②④C.①③⑤D.②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com