
科目: 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组制备肥皂的过程如下:
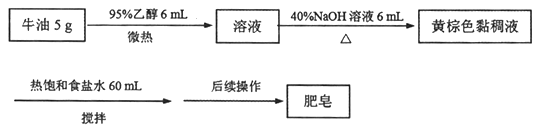
请回答:
(1)加入乙醇的目的是________;“后续操作”指________。
(2)证明牛油已反应完全的方法是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验过程可以达到实验目的的是( )
| 实验目的 | 实验过程 |
A. | 制取并纯化氨气 | 向浓氨水中加入生石灰,将产生的气体通过盛有 |
B. | 探究 | 向 |
C. | 比较 | 向 |
D. | 探究浓度对化学反应速率的影响 | 其他条件一定,向2支均盛有 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: H+、Na+、MnO![]() 、SO
、SO![]()
B. 碱性溶液中:Na+、K+、SiO![]() 、NO
、NO![]()
C. 能溶解Al2O3的溶液中:Mg2+、Cu2+、HCO![]() 、Cl-
、Cl-
D. 含有Fe2+的溶液中:H+、Ca2+、NO![]() 、AlO
、AlO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定容积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。则N2、H2、NH3的起始浓度不可能存在的数据是( )
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。则N2、H2、NH3的起始浓度不可能存在的数据是( )
A.N2为0.2mol/L,H2为0.6mol/L
B.N2为0.15mol/L
C.N2、H2均为0.18mol/L
D.NH3为0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45kJ的热量。丙烷在室温下燃烧的热化学方程式为____。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则2CH4(g)+ O2(g)=2CO(g)+4H2(g)ΔH=___;
(3)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol·L-1,在一定条件下发生反应:A(g)+B(g)![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为____。
②A的转化率为_____。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH___0(填“>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
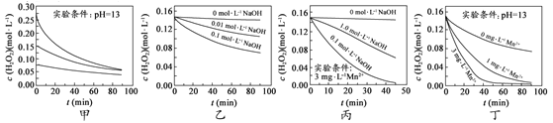
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目: 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸60mL置于图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从图中实验装置看,其中尚缺少的一种玻璃用品是_______,除此之外,装置中的一个明显错误是______。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于______。
(3)若改用60mL0.25mol·L-1H2SO4和60mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量____(填“相等”、“不相等”),若实验操作均正确,则所求中和热_____填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:______。(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:______。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(s) ΔH>0,若0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(s) ΔH>0,若0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A.0~15s内用I2的平均反应速率为v(I2)=0.001mol·L-1·s-1
B.c(HI)由0.07mol·L-1降到0.05mol·L-1所需的反应时间为小于10s
C.升高温度正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com