
科目: 来源: 题型:
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
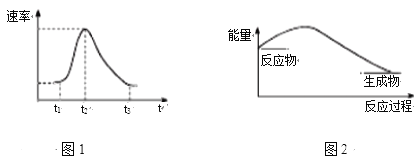
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
查看答案和解析>>
科目: 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号Z___________;
(2)写出下列元素在周期表中的位置W_______________;
(3)写出下列反应方程式:X单质在足量Y单质中反应_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)═CO(g)+2H2O(l) △H=-890.3kJmol-1
O2(g)═CO(g)+2H2O(l) △H=-890.3kJmol-1
B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+ H2O(l) △H<-57.3kJmol-1
BaSO4(s)+ H2O(l) △H<-57.3kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJmol-1
2NH3(g) △H=-38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s)+3O2(g)═2A12O3(s)△H=-2834.9kJmol-1,4Al(s)+2O3(g)═2A12O3(s) △H=-3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) H=196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C. 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是

A. 逐滴加入饱和食盐水可控制生成乙炔的速率
B. 用溴水验证乙炔的性质,不需要除杂
C. KMnO4酸性溶液褪色,说明乙炔具有还原性
D. 将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
查看答案和解析>>
科目: 来源: 题型:
【题目】I、铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。 “引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
Ⅱ、在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:

回答下列问题:
(1)写出加入n1mol铁所发生反应的离子方程式_______________________________。
(2)整个过程中转移电子的数目是________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为___________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一块11.0 g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 molL﹣1NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是
A.该合金中铁的质量为5.6 g
B.合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠反应,转移的电子数为0.6 NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A. 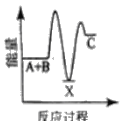 B.
B. 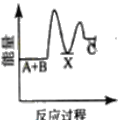
C. 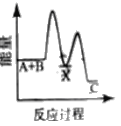 D.
D. 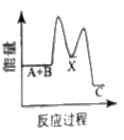
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com