
科目: 来源: 题型:
【题目】实验室制取的乙烯中常混有少量的![]() ,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
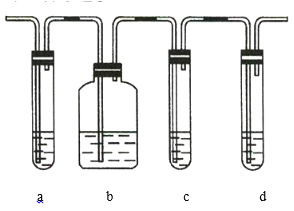
(1)图中a、b、c、d装置盛放的试剂依次是___________________(填序号)。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性高锰酸钾溶液
溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明![]() 存在的实验现象是______________________________________。
存在的实验现象是______________________________________。
(3)使用装置b的目的是________________________。
(4)使用装置c的目的是________________________。
(5)能说明混合气体中含有乙烯的现象是____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是![]()
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀.
先形成沉淀.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
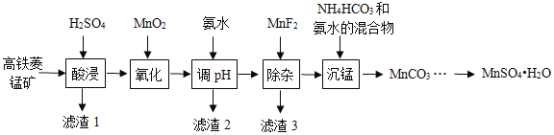
【题目】![]() 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为![]() ,含有
,含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质)制备,部分工艺流程如图所示:
等杂质)制备,部分工艺流程如图所示:
相关金属离子生成氢氧化物沉淀的![]() (开始沉淀的
(开始沉淀的![]() 按离子浓度为
按离子浓度为![]() 计算):
计算):
金属离子 |
|
|
|
|
|
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”时发生反应的离子方程式为______________。
(2)“调![]() ”范围至5~6,得到滤渣2的主要成分除
”范围至5~6,得到滤渣2的主要成分除![]() 外还有_____________。
外还有_____________。
(3)“除杂”过程中加入![]() 的目的是______。
的目的是______。
(4)“沉锰”过程中发生反应的化学方程式为______。
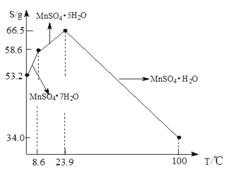
(5)![]() 在水中的溶解度与温度关系如图。由
在水中的溶解度与温度关系如图。由![]() 获得较纯净的
获得较纯净的![]() 晶体的方法是:将
晶体的方法是:将![]() 溶于适量的稀硫酸,控制温度在
溶于适量的稀硫酸,控制温度在![]() 之间蒸发结晶,______,得到
之间蒸发结晶,______,得到![]() 晶体,洗涤、烘干。晶体通常采用减压烘干的原因是______。
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
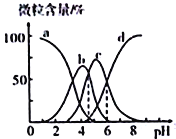
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铝、铁是三种重要金属,它们的单质和化合物应用十分广泛。回答下列问题:
(1)镁、铝第一电离能大小的关系是I1(Mg)___I1(Al),金属镁、铝熔点大小关系是Mg___Al。(填“大于”、“等于”或“小于”)
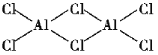
(2)氯化铝加热时易升华,实验测得铝元素与氯元素形成化合物的实际组成为Al2Cl6,其结构简式如图所示。其中处于中间的Cl原子杂化轨道类型为___杂化,分子中所有原子___(能、不能)在同一平面上。
(3)硝酸铁和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁]。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为___。尿素分子中σ键与π键的数目之比为___。NO3-的空间构型为___,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为___杂化。
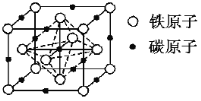
(4)碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构如图所示。晶体中与相邻铁原子距离相等且最近的铁原子有___个,该物质的化学式为___。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___pm(阿伏加德罗常数的值为NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答下列问题:
(1)与(HB=NH)3互为等电子体的分子为________(填分子式)
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的结构类似,则其晶体中每个硼原子与____个氮原子相连,每个氮原子与_____个硼原子相连。
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物。该反应的化学方程式为___________。
(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
化学键 | B—H | B—O | B—B |
键能(kJ·mol-1) | 389 | 561 | 293 |
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化合物,其原因为____________。
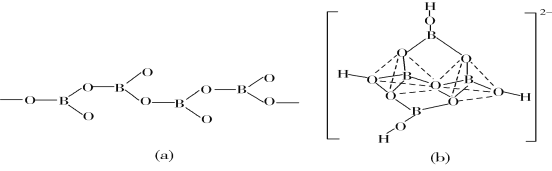
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图(a)为一种无限长单链结构的多硼酸根,其化学式为________;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)用电子式表示C的氢化物的形成过程_________(用元素符号表示)。
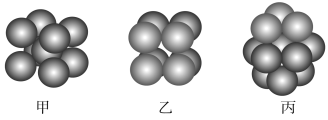
(2)F原子的外围电子排布式为________,F的晶体中原子的堆积方式是下图中的______(填“甲”“乙”或“丙”)。
(3)D与E、G与E形成的晶体类型相同,但晶体的配位数不同,其原因是________。
(4)已知DE晶体的晶胞如图所示。若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A-A键的键长为a cm,NA表示阿伏加德罗常数),则该晶胞中含有________个A原子,该晶体的密度是________g/cm3。
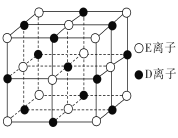
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,对于反应2SiHCl3(g)![]() SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
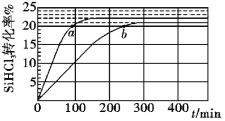
A.该反应的正反应活化能大于逆反应活化能
B.a、b处反应速率大小:va大于vb
C.温度一定时使用更优质催化剂,可使k正、k逆增大,k正与k逆的比值增大
D.343K时反应的平衡常数K=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com