
科目: 来源: 题型:
【题目】硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶![]() 含
含![]() 、
、![]() 等杂质
等杂质![]() 的提纯流程如下。
的提纯流程如下。![]() 已知:硝酸锶、硝酸钡不溶于浓硝酸
已知:硝酸锶、硝酸钡不溶于浓硝酸![]()

![]() 要加快“酸浸”速率所采取的措施是_________
要加快“酸浸”速率所采取的措施是_________![]() 写一条即可
写一条即可![]() 。
。
![]() 操作1的名称是 _____________,洗涤所用的洗涤剂是 ________。
操作1的名称是 _____________,洗涤所用的洗涤剂是 ________。
![]() “滤液2”中过量的
“滤液2”中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式 _________;氧化产物与还原产物的物质的量之比为 _________。
,同时放出无污染的气体,写出发生反应的离子方程式 _________;氧化产物与还原产物的物质的量之比为 _________。
![]() 已知
已知![]() 不溶于水,还原后调节
不溶于水,还原后调节![]() 的目的是 ________。
的目的是 ________。
![]() 为了测定“残渣2”中Cr元素的质量分数,进行以下实验。
为了测定“残渣2”中Cr元素的质量分数,进行以下实验。![]() 已知:
已知:![]() 残渣
残渣![]()
![]() “残渣2”中Cr元素的质量分数为 _______
“残渣2”中Cr元素的质量分数为 _______![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会是 ________
若加入的HI溶液过量太多,测定结果会是 ________![]() 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”![]() ,其原因是 ______。
,其原因是 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;它有如图所示的转化关系。E是有香味的有机物,F是高分子化合物(已知醛类氧化可生成羧酸)。
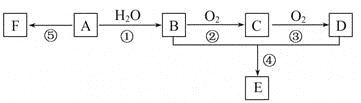
(1)B、D分子中的官能团名称分别是_________、_________。
(2)写出下列反应的化学方程式及反应类型:
①________;反应类型________。②________;反应类型________。
④________;反应类型________。⑤________;反应类型________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.1mol· L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示。下列说法正确的是
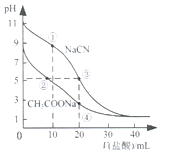
A.①所示溶液中:c(Cl-)>c(HCN)>c(CN-)>c(OH-)
B.②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.阳离子物质的量浓度之和:②与③所示溶液中相等
D.④所示溶液中:c(CH3COOH)+ c(H+)-c(OH-)=0.05 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是我国药学家屠呦呦在1971年发现的一种含有过氧基团的倍半萜内酯的无色针状晶体,不溶于水,易溶于乙醇、石油醚、苯等有机溶剂,熔点为156℃,沸点389.9℃,热稳定性差。一种超声提取青蒿素的主要工艺流程如图:
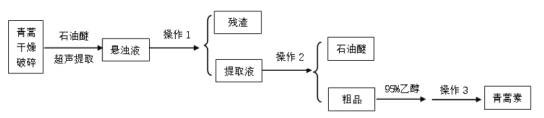
已知:石油醚的沸点为30~80℃,青蒿素在95%乙醇中的溶解度随温度的升高而增大。下列说法不正确的是( )
A.超声提取的原理是在强大的超声波作用下,使青蒿细胞乳化、击碎、扩散,其优点是加速溶解
B.操作1的名称是萃取
C.操作3的步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.操作3中若温度过高,会降低青蒿素的产率,其原因可能是青蒿素热稳定性差
查看答案和解析>>
科目: 来源: 题型:
【题目】硒![]() 与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥
与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥![]() 主要成分是Se,含有CuSe,
主要成分是Se,含有CuSe,![]() 等杂质
等杂质![]() 为原料,提炼硒的流程如下:
为原料,提炼硒的流程如下:
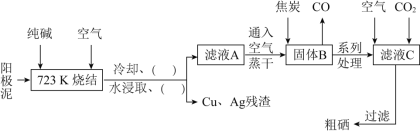
请回答下列问题:
![]() 硒原子的次外层电子数为________,与硒同周期相邻元素是________
硒原子的次外层电子数为________,与硒同周期相邻元素是________![]() 填元素名称
填元素名称![]() 。
。
![]() 已知滤液A中主要成分是
已知滤液A中主要成分是![]() ,可用于治疗克山病,则
,可用于治疗克山病,则![]() 的化学名称为________;滤液C中主要成分是
的化学名称为________;滤液C中主要成分是![]() ,则
,则![]() 的电子式为________。
的电子式为________。
![]() 上述流程图中的括号内“
上述流程图中的括号内“![]()
![]() ”,按操作先后顺序依次填写的内容是________、________。
”,按操作先后顺序依次填写的内容是________、________。
![]() 写出高温下用焦炭还原固体B的化学方程式________。
写出高温下用焦炭还原固体B的化学方程式________。
![]() 滤液C中析出硒的离子方程式为________。
滤液C中析出硒的离子方程式为________。
![]() 向
向![]() 溶液中滴加稍过量的乙酸,其离子方程式为________。已知:
溶液中滴加稍过量的乙酸,其离子方程式为________。已知:![]() 、
、![]() 、
、![]() 。
。
![]() 粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:

蒸馏操作中控制的最佳温度是________![]() 填标号
填标号![]() 。
。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】雄黄![]() 酒,即是用研磨成粉末的雄黄泡制的白酒或黄酒,中华民族传统节日端午节的饮品。雌黄
酒,即是用研磨成粉末的雄黄泡制的白酒或黄酒,中华民族传统节日端午节的饮品。雌黄![]() 是工业制取高纯度砷的重要原料,下图是工业制纯砷流程:
是工业制取高纯度砷的重要原料,下图是工业制纯砷流程:

已知:砷在元素周期表中,位于硅元素相邻的右下角位置。
![]() 操作1的名称________。
操作1的名称________。
![]() 写出雌黄浆中通入氧气的化学方程式________。
写出雌黄浆中通入氧气的化学方程式________。
![]() 在粗砷的提纯过程中通常将温度控制在
在粗砷的提纯过程中通常将温度控制在![]() 以上,其目的是什么?________。
以上,其目的是什么?________。
![]() 在粗砷的提纯过程中,通入氯气这步操作为什么必须在干燥的环境中进行?________。
在粗砷的提纯过程中,通入氯气这步操作为什么必须在干燥的环境中进行?________。
![]() 写出
写出![]() 在灼烧条件下生成
在灼烧条件下生成![]() 的化学方程式:________。
的化学方程式:________。
![]() 砒霜的主要成分是
砒霜的主要成分是![]() ,古时候确定人是否砒霜中毒,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀硫酸,得到一种气体A,加热气体A,会得到单质砷。请写出A的化学式________。
,古时候确定人是否砒霜中毒,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀硫酸,得到一种气体A,加热气体A,会得到单质砷。请写出A的化学式________。
![]() 亚砷酸
亚砷酸![]() ,是三元弱酸,第一步和第二步产生
,是三元弱酸,第一步和第二步产生![]() 是通过和水中的氢氧根结合实现的,第三步则直接电离出
是通过和水中的氢氧根结合实现的,第三步则直接电离出![]() 。第一步电离方程式为:
。第一步电离方程式为:![]() ,第二步的电离方程式为________。
,第二步的电离方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨反应为N2(g)+3H2(g) ![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,N≡N键的键能是945.6 kJ·mol-1,则上述反应的ΔH=_________________________。
(2)上述反应的平衡常数K的表达式为_______________________________。
若反应方程式改写为![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
(3)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填“大于”、“小于”或“等于”)v逆。
②由上表中的实验数据计算得到“浓度时间”的关系可用下图中的曲线表示,表示c(N2)t的曲线是_____。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)t的曲线上相应的点为________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】高纯硝酸锶![]() 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
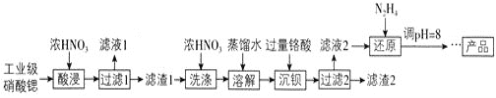
已知:![]() 滤渣1的成分为
滤渣1的成分为![]() 、
、![]() ;
;![]() 铬酸
铬酸![]() 为弱酸。
为弱酸。
![]() 酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
![]() 相对于水洗,用浓硝酸洗涤的优点是___________。
相对于水洗,用浓硝酸洗涤的优点是___________。
![]() 滤液2中过量的
滤液2中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式:________。
,同时放出无污染的气体,写出发生反应的离子方程式:________。
![]() 已知
已知![]() 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是![]() 结合离子方程式说明理由
结合离子方程式说明理由![]() __________。
__________。
![]() 为了测定滤渣2中
为了测定滤渣2中![]() 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2![]() 溶液
溶液![]()
滴定终点时消耗![]() 溶液
溶液![]() 已知:
已知:![]() 。
。
![]() 滤渣2中
滤渣2中![]() 摩尔质量为
摩尔质量为![]() 的质量分数为___________
的质量分数为___________![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会_________
若加入的HI溶液过量太多,测定结果会_________![]() “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论 |
A | 向黄色的 | 溶液变为紫红色 | 氧化性: |
B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中含有 |
C | 向 | 得到白色沉淀 | 相同温度下,溶度积常数: |
D | 一定温度下,向 | 溶液橙色变浅 | 减小 |
A.AB.B C.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com