
科目: 来源: 题型:
【题目】绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是________(填序号)。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)某化工厂排放的污水中含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子。某同学设计了从该污水中回收金属铜的方案。
四种离子。某同学设计了从该污水中回收金属铜的方案。
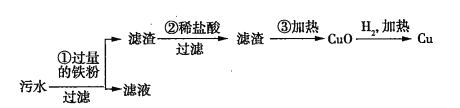
在回收金属铜的方案中,操作_______会导致环境污染,为防止污染,应采取的措施是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
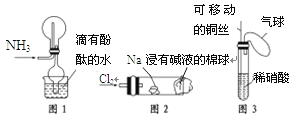
①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
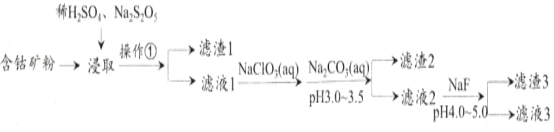
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3/span>的作用是_______________________________________,相关的离子方程式为__________________________________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为________________________(写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
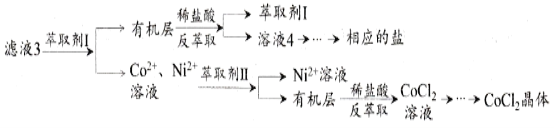
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)一I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
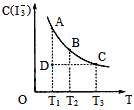
A. 反应I2(aq)+I-(aq)=I3-(aq)△H<0
B. 若温度为T1、T2反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目: 来源: 题型:
【题目】用来减轻感冒症状的布洛芬的结构简式如图所示,下列有关说法不正确的是( )
![]()
A.1mol布洛芬能与足量NaHCO3溶液反应最多生成1molCO2
B.布洛芬的分子式为C13H18O2
C.布洛芬苯环上的一溴代物有2种
D.布洛芬与苯甲酸甲酯是同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示为工业合成氨的流程图。有关说法错误的是

A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
查看答案和解析>>
科目: 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:

已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P)的合成路线如下图所示:

已知:①HC≡CH+RCOOH![]()
![]()
②RCOOR’+R”OH![]() RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
请回答:
(1)A中的官能团是____________________。
(2)C的结构简式是____________________。
(3)D→E的反应类型是____________________。
(4)E→G的化学方程式是______________________________________。
(5)已知:H是芳香族化合物。在一定条件下2B → K + H2O,K的核磁共振氢谱只有一组峰。J→L的化学方程式是____________________。
(6)L在体内可较快转化为具有药效的J,而化合物P与L相比,在体内能缓慢持续释放J。
① 血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用:______________________________________________________________。
② 下列说法正确的是______(填字母)。
a.P中的酯基在体内可缓慢水解,逐渐释放出J
b.P在体内的水解产物中没有高分子化合物
c.将小分子药物引入到高分子中可以实现药物的缓释功能
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )
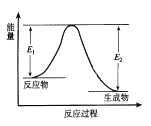
A. 反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B. 反应体系中加入催化剂,反应速率增大,△H增大
C. △H < 0,反应达到平衡时,升高温度,A的转化率减少
D. △H > 0,反应达到平衡时,增大压强,A的转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com