
科目: 来源: 题型:
【题目】实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/ ![]() )和质量分数为36.5%的浓盐酸(密度1.19g/
)和质量分数为36.5%的浓盐酸(密度1.19g/ ![]() )来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A. 该王水中硝酸的物质的量浓度是3.5mol/L
B. 该王水中氧元素的质量是100.8g
C. 该王水的密度约为1.24g/ ![]()
D. 该王水中HCl的质量分数约为26.2%
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关“暖宝宝”贴是一种便捷取暖用品。是利用铁(①)的氧化反应放热来发热。实际上是根据铁在潮湿空气(②)中发生吸氧腐蚀的原理。同时利用活性炭的强吸附性,在活性炭的疏松结构中储有水(③)蒸气,水蒸汽液化成水滴,流出与空气和铁粉接触,在氯化钠(④)的催化作用下较为迅速的发生反应生成氢氧化铁(⑤,放出热 量,生成的氢氧化铁会缓 慢分解生成氧化铁⑥)。其总反应:4Fe+3O2+6H2O=4Fe(OH)3 ,2Fe(OH)3=Fe2O3+3H2O

(1)上述短文标有序号的物质中进行分类:
属于混合物的是_______( 填序号,下同),属于单质的是________,属于氧化物的是_______,属于碱的是__________,属于盐的是 __________。
(2)在反应4Fe+3O2+6H2O=4Fe(OH)3中,作为还原剂的物质是______。若反应中消耗了3 mol O2,则生成Fe(OH)3的物质的量为______mol,转移电子的物质的量为______ mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】春节期间要注意饮食健康。
(1)平时要多喝水。水在人体中有重要的生理功能。下列物质在人体中可以水解的是___ (填字母)
a.葡萄糖 b.氨基酸 c.油脂
(2)合理选择饮食。鸡鸭鱼肉是常见食材,它们富含的营养物质是油脂和___;富含淀粉的面点老少皆宜,淀粉的化学式是______;蔬菜和水果富含维生素C,组成维生素C的元素是___(填写元素符号)。
(3)橙汁是家宴的常用饮品。某品牌橙汁中含有白砂糖、精制盐、柠檬黄和苯甲酸钠,这几种物质中属于着色剂的是__。
(4)饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式_________。
(5)最好使用加碘食盐.是因为碘是人体内合成____激素的主要原料,缺碘会引起疾病。加碘食盐加入的是碘酸钾,其化学式为_____,其中碘元素的化合价为____;在食物中_____等海产品中含碘较多。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_______(写出化学式)。
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为______(写出化学式)。 实验室过滤需用到的玻璃仪器有烧杯、__________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______。
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
实验序号 | I | II | III |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为_____。
②所用NaOH溶液的浓度为___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为:C2H5OH+3O2===2CO2+3H2O,电池构造如下图所示。下列关于该电池的说法正确的是( )

A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是正极
C.该电池的正极反应为:4H++O2+4e-===2H2O
D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L
查看答案和解析>>
科目: 来源: 题型:
【题目】氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为:2H2O2(aq)=2H2O(l)+O2(g) ΔH=akJ·mol-1
①相同条件下,H2O2分解时,使用催化剂,不会改变的是___(填标号)。
A.反应热 B.反应速率 C.活化能 D.生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为:H2O2+2Fe3+=2Fe2++O2+2H+,第二步反应的化学方程式为___。
(2)已知:O2(g)+4HCl(g)![]() 2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

①该反应的速率v=k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是___(填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.平衡后分离出水蒸气,k变小
D.平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1___T2(填“>”或“<”)。该反应的ΔH___0(填“>”或“<”)。
③T2时,HCl的平衡转化率=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是( )
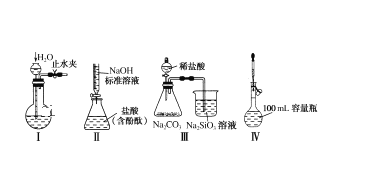
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目: 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在8~10 min内CO2的平均反应速率是
CH3OH(g)+H2O(g) ΔH<0。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在8~10 min内CO2的平均反应速率是

A. 0.5 mol·L-1·min-1B. 0.1 mol·L-1·min-1
C. 0 mol·L-1·min-1D. 0.125 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com