
科目: 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题
(1)煤的气化的主要化学反应方程式为________________
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为____________
(3)利用水煤气合成二甲醚的三步反应如下
①2H2(g)+CO(g)=CH3OH(g) △H=-90.8kJ.mo-1
②2CH3OH(g)= CH3OCH3(g)+ H2O(g) △H=-235kJ.mo-1
③CO(g)+H2O(g)=O2(g)+H2(g) △H=-413kJ.mo-1
总反应:3H2(g)+3CO(g)= CH3OCH3(g)+CO2(g)的△H=___________
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)![]()
a. 高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加Co的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)= CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400.此温度下,在2L密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量(mol) | 0.88 | 1.2 | 1.2 |
①加入的CH3OH的起始浓度为_________
②比较此时正、逆反应速率的大小:v正________v逆(填少”、“<”或“=”)
③若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率a(CH3OH)=_________c(CH3OCH3)=____________
查看答案和解析>>
科目: 来源: 题型:
【题目】能量是人类生存基础,因此化学反应与能量关系一直是研究热点,贯穿于生活和生产各个领域 .
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=___________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+![]() O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.
C(s)+![]() O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程__________
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图
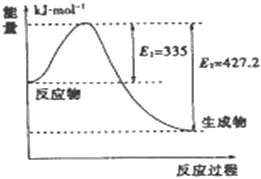
①请计算每生成1moNH3放出热量为___________
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为___________
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是_______

A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1molL-1KI溶液:Na+、Ba2+、Fe3+、OH-
B.0.1motL-1Fe2(SO4)3溶液:Zn2+、NH![]() 、Br-、SO
、Br-、SO![]()
C.0.1molL1HNO3溶液:Ba2+、K+、ClO-、Cl-
D.0.1molL-1NaAlO2溶液:Mg2+、Na+、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+l6N2↑。若氧化产物比还原产物多1.4mol,则下列判断正确的是( )
A.生成42.0LN2(标准状况)
B.有0.2molKNO3被氧化
C.转移电子的物质的量为1mol
D.被氧化的N原子的物质的量为1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH![]() 、Cl-、S2-
、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO![]() 、K+
、K+
④pH=2的溶液中:NH![]() 、Na+、Cl-、Cu2+
、Na+、Cl-、Cu2+
⑤由水电离出的c(OH-)=1×10-13molL-1的溶液中Mg2+、Ba2+、Cl-、Br-
A.②③B.①③C.①⑤D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】23℃时,有体积相同的四种溶液:①pH=3的 CH3COOH溶液②pH=3的盐酸③pH=11的氨水④pH=11的NaOH溶液。下列说法不正确的是
A.用蒸馏水将①稀释则 ![]() 增大
增大
B.等体积②和③的溶液混合后,溶液呈酸性
C.将③逐渐滴入②中,水的电离程度先增大后减小
D.③和④分别用②中和,消耗②的体积:③>④
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4 LCCl4含有的分子数为NA
B.标准状况下,aL氧气和氮气的混合气体含有的分子数约为![]()
C.46g NO2和N2O4的混合气体中含有的原子数为6NA
D.56gFe与足量的盐酸反应,转移的电子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是

A.恒温恒容下,再向B点体系充入N2O4,NO2的体积分数增大
B.图中A、C两点气体的颜色:A浅,C深
C.图中A、C两点气体的平均相对分子质量:A>C
D.温度T1>T2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入NaHCO3溶液,产生白色沉淀,则原溶液-定有Al3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO![]()
D.加入NaOH溶液,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定有NH![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)=2C(g),反应过程中C的百分含量与温度关系如图,下列正确的是

A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>k(c)
C.c向d变化时,v(正)<v(逆)
D.d点状态加入合适的催化剂可使c%增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com