
科目: 来源: 题型:
【题目】金刚石与石墨是同素异形体。100 kPa时,1 mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是

A.石墨转化为金刚石的反应为放热反应
B.石墨比金刚石更稳定
C.金刚石比石墨更稳定
D.破坏1 mol石墨的化学键所吸收的能量小于形成1 mol金刚石的化学键所放出的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________,基态铁原子的价电子排布图为_______
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。

(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子__________(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。

(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:

①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究化学反应“2Fe3++2I-2Fe2++I2”存在限度及平衡移动与物质的浓度、性质的关系,甲、乙两同学进行如下实验。
已知:a.含I2的溶液呈黄色或棕黄色。b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如下:

回答下列问题:
(1)甲同学利用实验②中i和ii证明Fe2(SO4)3溶液与KI溶液的反应存在限度,实验i中的现象是________,实验ii中a是________(化学式)溶液。
(2)用离子方程式表示实验②iii中产生黄色沉淀的原因________。
Ⅱ.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究
(实验过程)
序号 | 实验步骤1 | 实验步骤2 |
实验③ | 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 | 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol·L-1Fe2(SO4)3溶液,同时采集溶液的透光率数据 |
实验④ | 将盛有2mL0.1mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
实验⑤ | 将盛有2mL0.2mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
实验中溶液的透光率数据变化如图所示:

回答下列问题:
(3)乙同学实验③的目的是______。
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是______。
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极),探究化学平衡移动与I-与Fe2+浓度及还原性强弱关系,操作过程如下:

①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I—2Fe2++I2向正反应方向进行,b作______(填“正”或“负”)极,还原性I—>Fe2+。
②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol/LFeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+_____I—(填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,得出的结论有______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
A.容器内的压强不再改变B.c(SO2):c(O2):c(SO3)=2:1:2
C.SO2的转化率不再改变D.SO3的生成速率与SO3的消耗速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中 使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
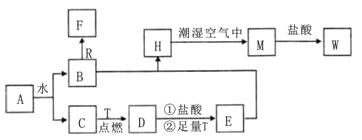
(1)物质A的化学式为 ________,F化学式为 ________;
(2)B和R在溶液中反应生成F的离子方程式为__________________________;
(3)H在潮湿空气中变成M的实验现象是________,化学方程式为______________;
(4)A和水反应生成B和C的化学方程式为__________________________
(5)印刷行业刻制印刷电路板(含有铜箔)时,要用W溶液中作为“腐蚀液”,写出该反应的离子方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
A. 在该温度下平衡常数K=1
B. 平衡常数与反应温度无关
C. CO的转化率为50%
D. 其他条件不变改变压强平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质分类的说法正确的是![]()
①稀豆浆、硅酸、氧化铁溶液都属于胶体
②纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
③明矾、冰水混合物、四氧化三铁都不是混合物
④![]() 、MgO、
、MgO、![]() 均属于碱性氧化物
均属于碱性氧化物
⑤葡萄糖、油脂都不属于有机高分子
⑥电解熔融的![]() 可制得金属铝
可制得金属铝
A.①②B.②③C.③⑤D.④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。

(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com