
科目: 来源: 题型:
【题目】在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为______(填化学式),V4+﹣O﹣H在反应过程中作___________。当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为____________L。

(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣538kJ·mol﹣1。断开1mol下列化学键系数的能量分别为N﹣H:390kJ、N≡N:946kJ、O﹣H:460kJ、O=O:498kJ。则断开1molN﹣N需要吸收的能量是__________.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①若其它条件不变,则下列图象不正确的是_____(填字母)。
A. B.
B.  C.
C. D.
D.
②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示。
| c(NH3)/mol·L﹣1 | c(O2)/mol·L﹣1 | c(NO)mol·L﹣1 |
0 | 1.2 | 1.75 | 0 |
4min | 0.4 | 0.75 | 0.8 |
6min | 0.4 | 0.75 | 0.8 |
8min | 0.6 | 1 | 0.6 |
9min | 0.6 | 1 | 0.6 |
10min | 1.05 | 1 | 1.05 |
12min | … | … | … |
0~4min内,用O2表示该反应的平均反应速率为______mol·L﹣1·min﹣1。反应6~8min时改变了反应条件,改变的反应条件可能是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是

A.H+由阳极区向阴极区迁移
B.阳极电极反应:2HCl + 2e- == Cl2 + 2H+
C.阴极电极反应:Fe3+ + e- == Fe2+
D.阴极区发生的反应有:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,用![]() 滴定
滴定![]() 某一元酸HX,滴定过程中pH变化曲线如图所示。
某一元酸HX,滴定过程中pH变化曲线如图所示。

下列说法正确的是
A. HX溶液显酸性的原因是![]()
B. 点a,![]()
C. 点b,![]() 与
与![]() 恰好完全反应
恰好完全反应
D. 点c,![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是


A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,甲的压强比乙的压强大
3C(g)+D(s)的影响,甲的压强比乙的压强大
C.图3表示A、B两物质的溶解度随温度变化的情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)→2H2(g)+2CO(g)。
(1)该反应的平衡常数K=__。在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,则v(CH4)__。
(2)根据如图可得出n(CO2)消耗__n(CH4)消耗(填“>”、“<”和“=”,原因是___。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() 时
时
化学式 |
|
|
|
电离平衡常数 |
|
|
|
下列说法正确的是 ( )
A. 醋酸稀释过程中,![]() 逐渐减小
逐渐减小
B. ![]() 溶液中:
溶液中:![]()
C. 向醋酸或HCN溶液中加入![]() ,均产生
,均产生![]()
D. 物质的量浓度相同时![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】芯片主要由单晶体硅成。下图是硅及其化合物的类价二维图,根据要求完成下列化学方程式或离子方程式。

(1)利用焦炭在电炉中还原二氧化硅的化学方程式为_______________。
(2)利用氢氟酸刻蚀玻璃的化学方程式为_______________。
(3)硅酸钠转化为原硅酸的离子方程式_______________。
(4)二氧化硅与烧碱溶液反应的化学方程式_______________。
(5)石英与纯碱在玻璃熔炉里加强热发生反应的化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属保护的说法不正确的是 ( )
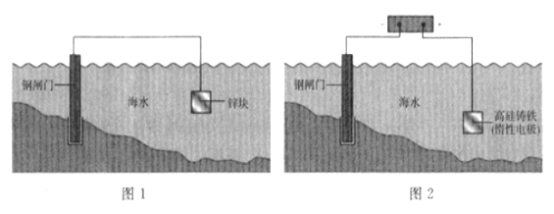
A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 钢闸门均为电子输入的一端
C. 锌和高硅铸铁的电板反应均为氧化反应
D. 两图所示原理均发生了反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com