
科目: 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温下4种溶液:①盐酸;②醋酸溶液;③氢氧化钠溶液;④氨水。已知①和②的pH为a,③和④的pH为b,且![]() b
b![]() 。则下列观点错误的是
。则下列观点错误的是
A.若![]() 时,则溶液④中水电离出的
时,则溶液④中水电离出的![]() 等于
等于![]()
B.若将①和③分别加水稀释100倍,则稀释后两溶液的pH之和仍为14
C.若将等体积的②和③分别与足量铝粉反应,生成的氢气后者多
D.若将①和④等体积混合,则混合后的溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42—)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:_____,指出使用空气的优点是:_______。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s) ΔH=-Q1 kJ/mol,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=______。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用____试剂可将其除去。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方法中,不能用于实验室里制取氨气的是( )
A.加热试管中的氯化铵固体
B.将烧瓶中的浓氨水加热
C.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
查看答案和解析>>
科目: 来源: 题型:
【题目】研究晶体的结构对化学新材料的发现有着重要的价值。
(1)晶胞中任一个原子的中心位置均可用称之为原子分数坐标的三个分别小于1的数(x,y,z)来予以规定。某晶体的晶胞结构如图所示,1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o; 3号原子坐标为_____________,列出上述晶体中A和B两原子间的最小核间距的计算式为_____________。(不必算出数值,但需要化简)

(2)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
(3)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________(结果保留两位有效数字)。
(4)钙钛矿晶体的结构如图所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围;钙离子位于立方晶胞的体心,一个钙离子被_____个氧离子包围。钙钛矿晶体的化学式为__________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm,钛离子与钙离子间最短距离为_______pm。

(5)钛元素有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示F晶体的结构中,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为_____________ g· cm-3
(用NA表示阿伏加德罗常数的值,列出计算式即可,不用化简)。

查看答案和解析>>
科目: 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中SO2最大使用量为0.25g·L1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择图中的___(填序号)。


(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
a.=10mL b.=40mL c.<10 mL d.>40mL
(3)上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:___。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为___g·L1。滴定终点读数时俯视刻度线,则测量结果比实际值___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为_________,价层电子的轨道表达式为_________。
(2)Ni的两种配合物结构如图所示:
A B
①A 的熔、沸点高于B的原因为_________。
②A晶体含有化学键的类型为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
③A晶体中N原子的杂化形式是_________。
(3) 人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As, 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为_________。
(4) NiAs的晶胞结构如图所示:

①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为_________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,下列说法正确的是
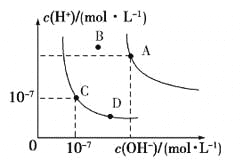
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com