
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A.丙属于碱性氧化物
B.W元素在周期表中的位置是第四周期VIIIB族
C.W的原子序数是Z的两倍,金属性弱于Z
D.常温下等物质的量的甲和戊加入过量浓硝酸中,消耗的HNO3物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:

(1)写出实验室制取氯气的离子方程式_____________,NA表示阿伏加德罗常数的值,若有3mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含4molHCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)1mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列实验装置或操作的说法中,正确的是( )



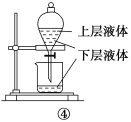
A.①可用于实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2
B.②实验中若左边棉花变橙色,右边棉花变蓝色,则能证明氧化性:Cl2>Br2>I2
C.③实验试管中会生成红色沉淀
D.用图④操作可提取碘水中的碘
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,下列说法不正确的是( )

A.Y的气态氢化物的稳定性一定比W的强
B.W的原子序数可能是Y的原子序数的2倍
C.Y原子形成的简单离子半径一定比X原子形成的简单离子半径大
D.若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,某一元酸(HB)的盐NaB的水溶液呈碱性,下列叙述正确的是( )
A.HB的电离方程式为HB===H++B-
B.NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-)
C.NaB溶液中:c(Na+)+c(H+)=c(HB)+c(B-)
D.0.1 mol/L NaB溶液中水电离的OH-浓度大于10-7 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】检验溶液中的离子或物质,所用方法正确的是( )
A.加入硝酸银溶液,有白色沉淀生成,证明一定有Cl-存在
B.加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有![]()
C.加入KSCN溶液,有红色物质生成,证明一定含有Fe2+
D.加入淀粉-KI溶液,变蓝色,说明可能有Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】向CH3COONa稀溶液中加入(或通人)少许X物质,其溶液中部分微粒的浓度变化如表所示(溶液温度不变)。
微粒 | H+ | OH- | CH3COO- | CH3COOH |
物质的量浓度 | 增大 | 减小 | 减小 | 增大 |
X物质是下列物质中的( )
A.氢氧化钠B.蒸馏水C.氯化氢D.磷酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com