
科目: 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
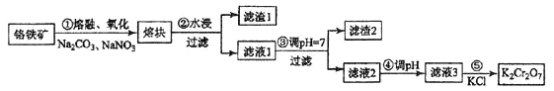
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知4P(红磷,s)![]() P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
A.当1mol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度时,水的离子积Kw=1×10-13,则该温度_________25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10molL-1,则该溶液的pH可能为________;
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液中各种离子的浓度由大到小的排列顺序是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类不同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于盐类水解反应的应用说法正确的是( )
A.可以把FeCl3固体直接溶于水制FeCl3溶液
B.热的纯碱溶液去油污效果好
C.Al(NO3)3溶液与K2S溶液混合后无明显现象
D.Mg粉投入到饱和NH4Cl溶液中无明显现象
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学院深圳先进技术研究院研发出一种新型铝一石墨烯双离子电池(AGDIB电池),该电池以溶有六氟磷酸锂![]() 的碳酸酯类溶剂为电解液放电时合金
的碳酸酯类溶剂为电解液放电时合金![]() 发生去合金化反应阴离子
发生去合金化反应阴离子![]() 从石墨烯C中脱嵌进入电解质溶液。放电时其工作原理如图所示,下列说法错误的是( )
从石墨烯C中脱嵌进入电解质溶液。放电时其工作原理如图所示,下列说法错误的是( )

A.该电池不能用水作为电解质溶液
B.放电时,a电极的电极反应式为Li-e-=Li+
C.废旧AGDIB电池进行“放电处理”时,若转移1mole-,则可回收7gLi
D.充电时,b电极的电极反应式为PF6--e-+Cx=CxPF6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com