
科目: 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________。
(2)反应②中的能量变化如下图所示,则△H2=______(用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________(写出一点)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某实验小组探究等量且表面积相同的镁条与硫酸铜溶液的反应。(注:反应前镁条用砂纸打磨除去表面氧化膜且镁条过量)
实验 | 操作 | 实验现象 |
Ⅰ | 4mL 0.1mol/LCuSO4溶液(pH约为4.2)
| 1.有无色无味气体生成 2.镁条表面逐渐生成大量黑褐色膨松状不溶物 3.反应一段时间后,溶液逐渐变浑浊,有蓝绿色沉淀生成 |
Ⅱ |
4mL 0.5mol/LCuSO4溶液(pH约为3.6) | 1.有大量无色无味气体生成 2.镁条表面逐渐生成红褐色不溶物 3.反应一段时间后,溶液中逐渐有蓝绿色沉淀生成,镁条上红褐色物质脱落,有光亮的红色物质生成 |
Ⅲ |
| 开始无明显现象,一段时间后产生微量无色无味气体 |
(1)实验Ⅰ中生成的无色无味气体的主要成分是________,产生原因是_________(用简单文字和离子方程式表示)。设计实验Ⅲ的目的是________。
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
实验 | 操作 | 实验现象 |
Ⅳ |
| 1.加入浓盐酸后,沉淀部分溶解。溶液为黄色 2.多次洗涤后的残余固体加入浓硝酸,有大量红棕色气体生成,溶液变为蓝色 |
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因_________。由实验Ⅳ可以推测,黑褐色不溶物中还含有_______。残余固体加入浓硝酸时,反应的化学方程式是________。
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜(Cu2(OH)2SO4)是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是(Cu2(OH)2SO4);
ii.是Cu(OH)2和(Cu2(OH)2SO4)的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立________。
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与__________有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和100g10%的K2SO4溶液,电极均为石墨电极.

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为______;
③电极b上生成的气体在标准状况下的体积:______;
④电极c的质量变化是______g;
⑤电解前后各溶液的pH值的变化(填“不变”、“变大”或“变小”):甲溶液______,乙溶液______,丙溶液______;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,____(填“能”或“不能”),原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填空.
(1)如图是常见仪器的部分结构。
A.  B.
B. ![]() C.
C.  D.
D. 
①写出仪器名称:B_____,C______。
②使用前需检查是否漏水的仪器有______________。(填仪器标号)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____,滴定终点时,锥形瓶中颜色变化为_______,且半分钟内颜色不复原。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______。
A .酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B .滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C .酸式滴定管在滴定前有气泡,滴定后气泡消失
D .读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
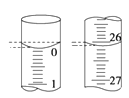
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
(5)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度______。(保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】某种降血压药物硝苯地平的合成路线如下:

已知:
 +R”’CHO
+R”’CHO
(1)A 的结构简式是 ___________。
(2)B与新制Cu(OH)2 反应的化学方程式是 ______________。
(3)H → I的反应类型是 _______________。
(4)试剂a 是 _______________。
(5)J→K的化学反应方程式是 ___________。
(6)F 有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式__________。
①分子中含有酯基,且存在顺反异构
②能与金属Na单质反应,且能发生银镜反应
(7)1 mol 硝苯地平最多可与__________mol NaOH溶液发生水解反应。
(8)已知 D![]() E→F +CH3OH,E的结构简式是_______________。
E→F +CH3OH,E的结构简式是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)。
4NO(g) + 6H2O(g)。
(1)升高温度,反应的平衡常数K值减小,则该反应的焓变△H_____0(填“>”、“<”或“=”)。
(2)下列能说明上述反应已达到平衡状态__________(填序号)
A.NH3的浓度不随时间变化
B.v正(O2)= v逆(NO)
C.体系的分子总数不再变化
D.单位时间内消耗4molNH3的同时生成6molH2O
(3)若其他条件不变,下列关系图错误的是______(选填序号)。
A.  B.
B.  C.
C.  D.
D. 
(4)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(mol·L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2 min | 3.2 | 0.8 | 1.2 | |
第 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
①上表中空白处应填的数字为______。
②反应在第 2 min 到第 4 min 时,反应速率v(O2)=___________。
③反应在第 2 min 时改变了条件,改变的条件可能______;该条件下,反应的平衡常数K=_______(只写计算结果,不标单位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g) ![]() 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是

A.升高温度.平衡常数增大
B.W点Y的正反应速率等于M点Y的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目: 来源: 题型:
【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1B.649 kJ· mol-1C.945.6 kJ· mol-1D.896 kJ· mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com