
科目: 来源: 题型:
【题目】下列热化学方程式中的ΔH最小的是
A. NaOH (aq) + HCl (aq) ===NaCl (aq) + H2O (l) ΔH1
B. NaOH (aq) + ![]() H2SO4 (aq) ===
H2SO4 (aq) ===![]() Na2SO4 (aq) + H2O (l) ΔH2
Na2SO4 (aq) + H2O (l) ΔH2
C. CH3COOH (aq) + NaOH (aq) ===CH3COONa (aq) + H2O (l) ΔH3
D. NaOH (aq) + ![]() H2SO4 (浓) ===
H2SO4 (浓) ===![]() Na2SO4 (aq) + H2O (l) ΔH4
Na2SO4 (aq) + H2O (l) ΔH4
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,满足下列条件的溶液一定呈碱性的是( )
A.c(H+)<c(OH-)B.pH=7.2
C.能与金属Al反应放出H2D.能使广泛pH试纸呈红色
查看答案和解析>>
科目: 来源: 题型:
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,下图是利用手持技术得到的微粒物质的量变化图,常温下向![]() 溶液中滴加
溶液中滴加![]() 溶液.下列说法正确的是
溶液.下列说法正确的是![]()

A.![]() A在水中的电离方程式是:
A在水中的电离方程式是:![]()
![]()
![]() ;HA
;HA![]()
B.当![]() 时,则有:
时,则有:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
C.当![]() 时,则有:
时,则有:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
D.当![]() 时,其溶液中水的电离受到抑制
时,其溶液中水的电离受到抑制
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.酸碱中和滴定曲线是以酸碱滴定过程中滴加碱(或酸)的量或中和百分数为横坐标,以溶液 pH 为纵坐标,绘出溶液 pH 随碱(或酸)的滴加量而变化的曲线。它描述了滴定过程中溶液 pH 的变化情况,特别是滴定终点附近溶液 pH 的突变情况。下图为某浓度的 NaOH 溶液滴定 10.00mL 一定浓度的盐酸的图像

根据图像分析计算:
(1)HCl 溶液的浓度是___________,NaOH 溶液的浓度是____________。
(2)若向 20mL 稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
A.  B.
B. 
C.  D.
D. 
Ⅱ.下图为水在 T1℃和 T2℃时(T1<T2)对应的电离平衡曲线,回答下列问题:

(1)在T2℃时,若10体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________________。
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液,若将二者等体积混合,混合溶液的pH>7,则BOH为_________碱,(填“强”或“弱”),判断的理由是_________。
(3)在曲线A所对应的温度下,向一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,所得混合液的pH=11,则两溶液的体积比V[Ba(OH)2]∶V(NaHSO4)=_________(假定混合液的总体积等于混合前两溶液体积之和)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.工业合成氨反应在生产中具有重要意义,完成下列问题:
(1)写出合成氨反应的热化学方程式:____。
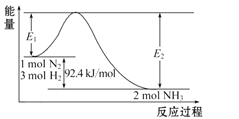
(2)在甲乙两个体积均为 2L 固定容积的密闭容器中,分别充入甲:1molN2、3molH2 和乙:2molN2、6molH2(其它条件相同),经过足够长的时间后,在乙容器中放出热量_____________ (填“大于”、 “小于”或“等于”)在甲容器中放出热量的 2 倍。
(3)下列图像分别代表焓变(△H)、混合气体平均相对分子质量(![]() )、N2 体积分数 φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是_____________ 。
)、N2 体积分数 φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是_____________ 。
A. 
B. 
C. 
D. 
Ⅱ.常温下,有浓度均为 0.1 mol·L-1 的下列 4 种溶液:①H2SO4 溶液②CH3COOH 溶液③Na2CO3 溶液④NaOH 溶液
(1)以上 4 种溶液 pH 由大到小的排列顺序是______________(填序号),其中由水电离出的H+浓度最小的是____________ (填序号)。
(2)③溶液中离子浓度由大到小的顺序____________。
(3)该温度下向②中加入少量 CH3COONa,此时![]() 的值____________(填“增大”、“减小”或“不变”)。
的值____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】空气质量与我们的健康息息相关,目前我国通过监测 6 项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2 和 CO 是其中 3 项中的污染物。
(1)一定温度下,向固定体积为 2 L 的密闭容器中充入 SO2 和 NO2 各 1 mol,发生反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
(2)甲醇日趋成为重要的有机燃料,通常利用 CO 和 H2 合成甲醇,其反应的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:

①上述合成甲醇的反应为__________反应(填“放热”或“吸热”)。
②A、B、C 三点的平衡常数 KA、KB、KC 的大小关系为__________。A、B 两点对应的压强大小关系是 PA__________PB(填“大于”、 “小于”或“等于”)。
(3) 若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为____________,理论上通过外电路的电子最多为__________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了减少 CO 对大气的污染,某研究性学习小组拟研究 CO 和 H2O 反应转化为绿色能源H2。已知:
2CO(g)+O2(g) =2CO2(g); H=-566kJ·moL-1
2H2(g)+O2(g) =2H2O(g); H=-483.6kJ·moL-1
H2O(g) =H2O(l); H=-44.0kJ·moL-1
(1)表示氢气燃烧热的化学方程式中 △H=__________。
(2)写出CO和 H2O(g)作用生成 CO2 和 H2 的热化学方程式____________________________________________。
(3)往 1L 体积不变的容器中加入 0.200mol CO 和 1.00mol H2O(g),在 t℃时反应并达到平衡,若该反应的化学平衡常数 K=1(方程式中各物质前化学计量数为最简比),则 t℃时 CO 的转化率为____;反应达到平衡后,升高温度,此时平衡常数将__________ (填“变大”、 “不变”或“变小”),平衡将向__________ (填“正”或“逆”)方向移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关图像的说法正确的是

A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为 C(s)+2H2(g) ![]() CH4(g)。在VL 的容器中投入 amol 碳(足量),同时通入 2amolH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是( )
CH4(g)。在VL 的容器中投入 amol 碳(足量),同时通入 2amolH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是( )

A.在 4MPa、1200K 时,图中 X 点 v 正(H2)<v 逆(H2)
B.在 5MPa、800K 时,该反应的平衡常数为![]()
C.上述正反应为吸热反应
D.工业上维持 6MPa、1000K 而不采用 10MPa、1000K,主要是因为前者碳的转化率高
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.若向容器中充入惰性气体,则平衡向右移动
D.物质A一定为非气态,且正反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com