
科目: 来源: 题型:
【题目】下列有关盐类水解的事实或应用、解释的说法不正确的是( )
事实或应用 | 解释 | |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 泡沫灭火器灭火 | Al2(SO4)3与NaHCO3溶液反应产生CO2气体 |
C | 施肥时,草木灰(主要成为K2CO3)与NH4Cl不能混合使用 | K2CO3与NH4Cl反应生成NH3,降低肥效 |
D | 明矾[KAl(SO4)2·12H2O]作净水剂 | 明矾溶于水生成Al(OH)3 胶体 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amolL-1的氨水与0.01molL-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=__。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__,溶液中离子浓度大小关系为__。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2molL-1,则该温度下pH=3、c(HSO3-)=0.1molL-1的NaHSO3溶液中c(H2SO3)=__。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__。(已知lg2=0.3)
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。
①NaHA溶液的pH___(填大于、小于或等于)Na2A溶液的pH。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是__。
A.c(H+)c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq)ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有___。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(2)常温下,若在0.10molL-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___molL-1(Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(7分)有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;
⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;
属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数随溶液pH的变化关系如图所示。下列说法错误的是( )

A. 常温下,H2A的电离平衡常数 Ka1=10-3.30
B. 当 c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性
C. pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D. V(NaOH溶液):V(H2A溶液)=3∶2 时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO![]() )、c(NO
)、c(NO![]() )和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
)和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
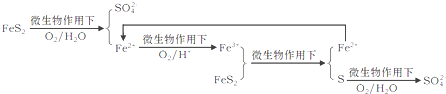
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物反应如下图,据此回答下列问题:

(1)乙烯的结构式为:__________。
(2)写出反应②③④的化学方程式:
②_________________________,反应类型:___________;
③_________________________,反应类型:___________;
④_________________________,反应类型:___________。
(3)实验室常用下列装置制取乙酸乙酯,请回答相关问题:

①浓硫酸的作用是_______________。
②饱和碳酸钠溶液的主要作用是___________________。
③若要把制得的乙酸乙酯分离出来,应采用的操作是_________。
④进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com