
科目: 来源: 题型:
| △ |
| △ |
查看答案和解析>>
科目: 来源: 题型:
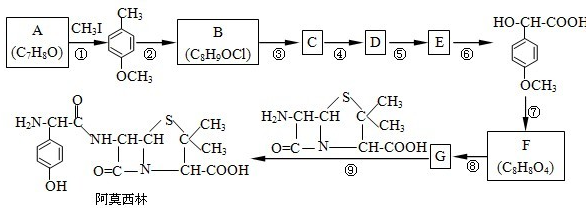
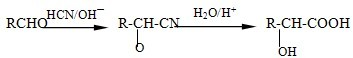




 同分异构体中,能与氯化铁溶液发生显色反应,且苯环上的一氯代物有两种的有机物有
同分异构体中,能与氯化铁溶液发生显色反应,且苯环上的一氯代物有两种的有机物有

查看答案和解析>>
科目: 来源: 题型:

 外,还可能有
外,还可能有查看答案和解析>>
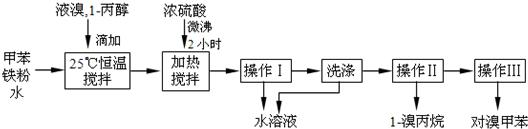
科目: 来源: 题型:阅读理解
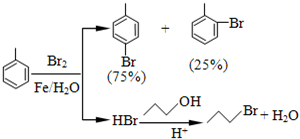
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | |
| 沸点℃ | 110.8 | 97.2 | 71 | |
| 物质 | 对溴甲苯 | 邻溴甲苯 | ||
| 沸点℃ | 184.3 | 181.7 | ||
查看答案和解析>>
科目: 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:
| △ |
| △ |
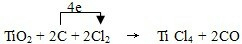
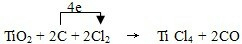
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
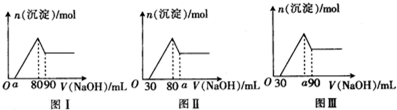
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com