
科目: 来源: 题型:
【题目】颠茄酸酯(J)是一种溃疡病治疗的辅助药物,其合成路线如下,回答下列问题:
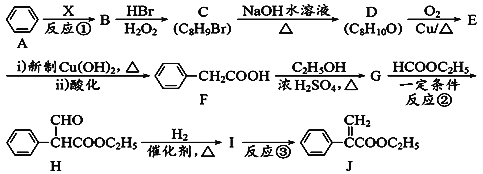
(1) 烃B的相对分子质量为104,分子中氢的质量分数为7.69%,且反应①为加成反应,则X含有的官能团的名称是_______________,物质B的名称为_______________。
(2) 反应③的反应类型为_______________。
(3) C的结构简式为_________________________。
(4) 写出D→E反应的化学方程式_____________________________________________。
(5) 化合物I有多种同分异构体,同时满足下列条件的结构有_________种。
①能发生水解反应和银镜反应;
②能与FeCl3发生显色反应;
③苯环上有四个取代基,且苯环上一卤代物只有一种。
其中某种同分异构体进行水解反应时,1mol该物质消耗3molNaOH,该同分异构体的结构简式为____________________。(写出一种即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P-P键数目为4NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 1mol FeI2与足量氯气反应时转移的电子数为2NA
D. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为6NA
组成的碳单质中所含质子数一定为6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是
A.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.将100 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴加到100 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.0.1 mol·L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+)
D.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数为0.001NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,将![]() 通入足量水中,生成
通入足量水中,生成![]() 的分子数为
的分子数为![]()
B.铁与稀硝酸反应生成的气体产物仅有![]() ,转移的电子数一定为
,转移的电子数一定为![]()
C.15g乙烷与1mol氯气充分反应,所得有机物中含有的氯原子数为![]()
D.![]() 中含有的质子数和中子数均为
中含有的质子数和中子数均为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】钙能调节人体各系统生理功能,利用如图装置测定碳酸钙型补钙剂中钙的含量。已知氨基磺酸(H2NSO3H)俗称固体硫酸,在水溶液中为一元酸,广泛应用于锅炉水垢的清洗。
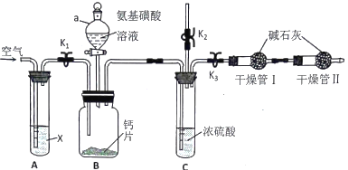
(1)仪器a的名称为____________________。
(2)A装置内X是___________________溶液(填化学式),B 装置内发生反应的化学方程式为____________________________。
(3)组装好仪器后,检查装置的气密性,接下来进行的操作是:打开K1、K2,关闭K3,通空气一段时间,关闭K1、K2,打开K3,打开仪器a活塞,滴入氨基磺酸溶液,待B装置中无气泡产生,关闭仪器a活塞。再次打开K1通空气一段时间,第二次通入空气目的是___________________________。干燥管Ⅱ的作用_________________________。
(4)取某补钙剂样品m克进行测定,测得干燥管Ⅰ在实验前后重量分别为m1克和m2克,则样品中钙的质量分数为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、NH![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶有一种溶质,则上述四种离子浓度的大小顺序为______(填序号)。
(2)若四种离子的关系符合②,则溶质为________________________。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是______(填图像符号)。
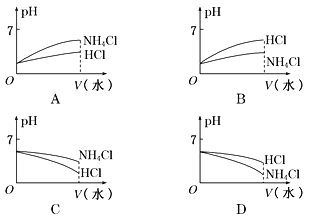
(4) 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_____________ c(NH3·H2O)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】日常生活中,汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH= -akJ/mol
2CO2(g) ΔH= -akJ/mol
②N2(g)+O2(g) ![]() 2NO(g) ΔH= +bkJ/mol
2NO(g) ΔH= +bkJ/mol
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH= -ckJ/mol
2NO2(g) ΔH= -ckJ/mol
回答下列问题:
(1)CO的燃烧热为____________________。
(2)CO将NO2还原为单质的热化学方程式为_____________________________。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率V(N2)=_________________________________。
②能说明上述反应达到平衡状态的是_______________。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。
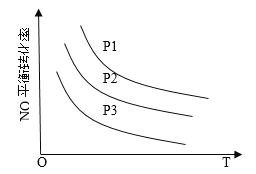
则NO的平衡转化率随温度升高而减小的原因是______________________________
图中压强(P1、P2、P3)的大小顺序为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com