
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A. 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 用FeS去除废水中的Hg2+:Hg2+ + S2- === HgS↓
C. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
D. NH4Cl溶于D2O中显酸性:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol K2Cr2O7被还原为Cr3+转移的电子数为3NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.1 L 0.1 mol·L-1磷酸钠溶液含有离子的数目为0.1NA
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
(1)邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应。
)的铜配合物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性由小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NH2中N原子的杂化方式为__杂化。
(2)第四周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素的基态原子电子排布式为___。
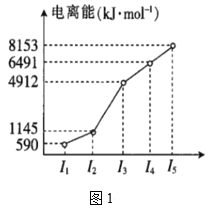
①嘌呤中轨道之间的夹角∠1比∠2大,原因是___。
②![]() 分子中的大π键可以用符号
分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
(3)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图3所示。
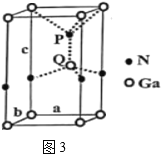
若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120o,阿伏加德罗常数的值为NA,则晶胞参数c=__(写出代数式)nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】过渡金属的单质及化合物很多有催化性能,氯化铜、氯化亚铜经常用作有机合成催化剂。实验室中用氯气与粗铜(杂质只有Fe)反应,制备铜的氯化物的流程如下。
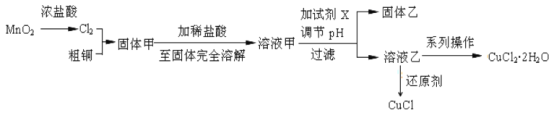
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
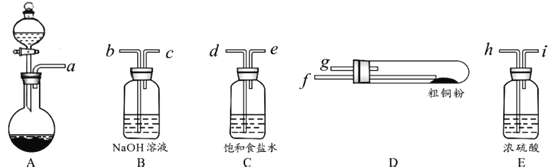
①按气流方向连接各仪器接口顺序是:a→_____、_____→h、i→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_____。
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是_____;
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_____。
a Cu(OH)2 b NH3·H2O c CuO d CuSO4
查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________。(提示:lg2=0.3)
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、________、_______、洗涤、干燥。
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:
C2H4(g)+H2O(l)=C2H5OH(l) ΔH1=-44.2kJ·mol-1
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) ΔH3=___。
(2)CO2甲烷化反应是由法国化学家Sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图:
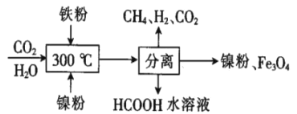
上述过程中,产生H2反应的化学方程式为__。
②HCOOH是CO2转化为CH4的中间体:CO2![]() HCOOH
HCOOH![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
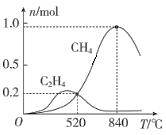
在1L恒容密闭容器中充入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。520℃时,CO2的转化率为__,520℃时,反应I的平衡常数K=__。
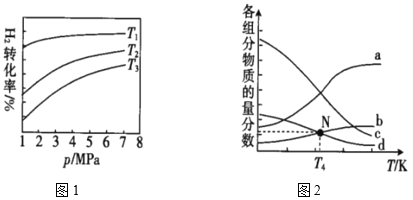
(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=![]() 。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
②m=3时,该反应达到平衡状态后p(总)=20Mpa,恒压条件下各物质的物质的量分数与温度的关系如图2。则曲线b代表的物质为___(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题。
(1)Al2(SO4)3溶液显酸性的离子方程式:____________________________;
(2)CuSO4溶液与过量氨水反应的离子方程式:____________________________;
(3)Mg-Al-NaOH溶液组成的原电池,负极的电极反应式:_________________________;
(4)CH3OH-O2燃料电池,KOH溶液作电解质,负极的电极反应式:____________________;
(5)惰性电极电解CuSO4溶液的总反应的化学方程式:______________________________;
(6)Na2C2O4溶液的物料守恒:______________________________;
(7)Fe3+的基态电子排布式:______________________________;
(8)N2H4的结构式:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图所示),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
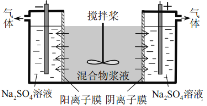
用惰性电极电解时,CrO42-能从浆液中分离出来的原因是_________________________,分离后含铬元素的粒子是__________,阴极室生成的物质为__________(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知25℃,H2C2O4的K1=5.0×10-2,K2=5.0×10-5。则NaHC2O4溶液显__________(填“酸性”或“碱性”)。
(2)已知25℃,H2CO3的K1=4×10-7,K2=5×10-11。CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为__________(写离子符号);若所得溶液中c(HCO3-):c(CO32-)=2:1,则溶液pH=__________。
(3)25℃时,V1L pH=11的NaOH溶液与V2L pH=3的H2SO4溶液混合,所得溶液的pH=10,则V1:V2=__________(混合过程中溶液的体积变化忽略不计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
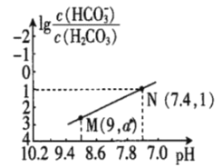
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
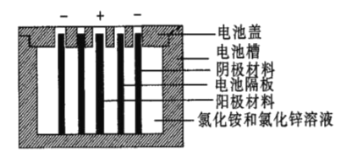
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com