
科目: 来源: 题型:
【题目】不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳原子的电子排布图为___。
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl2H2O中Cr3+的配位数为___。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____。
③氨是___分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___,氨的沸点高于PH3,原因是___。
(3)镍元素基态原子的价电子排布式为___,3d能级上的未成对电子数为___。
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是___。
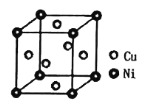
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=___nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:
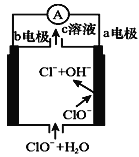
Mg+ClO-+H2O=Mg(OH)2+Cl-
下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的命脉。河水01是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和溉溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1molL-1的NaOH溶液中,由水电离出的c(OH-)=___molL-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___。
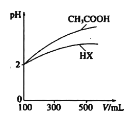
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___(填“大于”或“小于”或“等丁”)CH3COOH的电离平衡常数,理由是___。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
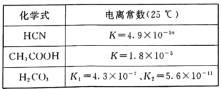
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为____。
②向NaCN溶液中通人少量的C02,发生反应的化学方程式为___。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH = 6,则溶液中c(CH3COO-)-c(Na+)=___molL-1(填精确值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W,A是短周期中原子半径最大的元素,常温下X、Z、W均可与Y反应,A、C、D的原子序数及0.1mol/L X、Z、W溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
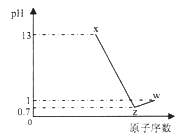
A. A的离子半径小于B的离子半径
B. W、X两物质含有的化学键类型相同
C. D氢化物稳定性小于C氢化物稳定性
D. B的简单离子会影响水的电离平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目: 来源: 题型:
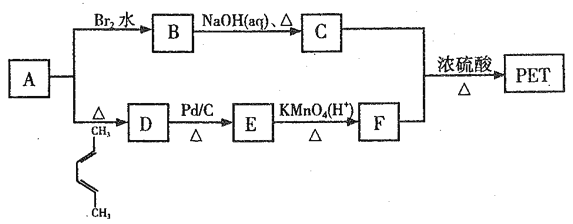
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为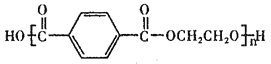 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:
已知:①![]() ;②
;②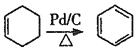 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一氧化碳是一种重要的化工原料。结合所学知识回答下列问题:
(1)工业上可通过CO和H2化合制取CH3OH:
CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
已知:①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
则△H1=___。
(2)二氧化碳的回收利用是环保领域研究的热点课题。
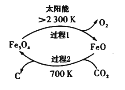
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为___。
(3)工业上还可通过CO和Cl2化合制取光气(COCl2):Cl2(g) +CO(g)=COCl2(g) △H。向密闭容器中充入1molCl2(g)和1molCO(g),反应速率随温度的变化如图所示。
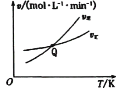
①图中Q点的含义是___,△H___0(填“>”或“<”)。
②某温度下,该反应达到平衡时c(COCl2)=0.80molL-1,c(Cl2)=0.20molL-1,则平衡体系中CO的体积分数为___(保留2位小数)。在该温度下,反应的平衡常数K=___。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图:
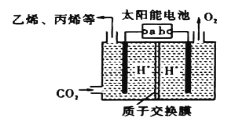
①b电极的名称是___。
②生成丙烯(C3H6)的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
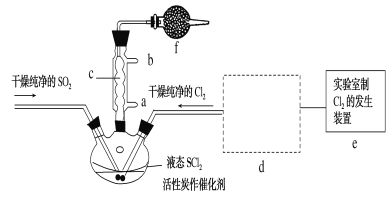
(1)下列四种制备SO2的方案中最佳选择是__。
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__。
(3)仪器f的作用是__。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__或__溶液,证明脱水过程发生了氧化还原反应。
查看答案和解析>>
科目: 来源: 题型:
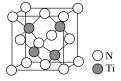
【题目】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为__个,能量最高的电子占据的能级符号为___。
(2)磷的一种同素异形体—白磷(P4)的立体构型为__,推测其在CS2中的溶解度__(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:__。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:___。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为__,已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长为__cm(用含ρ、NA的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是( )

A. 一元酸HA为弱酸
B. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
C. pH=7时,c(Na+)>c(A-)+c(HA)
D. b点所示溶液中c(H+)-c(OH-)=1/2[c(A-)-c(HA)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com