
科目: 来源: 题型:
【题目】用HCl滴定NaOH:c(NaOH)=![]() (填“偏大”或“偏小”或“无影响”)。
(填“偏大”或“偏小”或“无影响”)。
(1)酸式滴定管未润洗__________;
(2)碱式滴定管未润洗__________;
(3)锥形瓶用NaOH润洗__________;
(4)锥形瓶洗净后未干燥__________;
(5)酸式滴定管滴定前有气泡,滴定结束后无气泡__________;
(6)滴定时不小心滴到锥形瓶外__________;
(7)振荡锥形瓶时溶液溅出__________;
(8)滴定前仰视,滴定后俯视__________;
(9)滴定前平视,后仰视__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】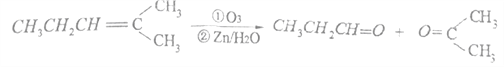
上述反应可用来推断烯烃的结构,某单烯烃A可以发生如下图示的转化,回答下列问题
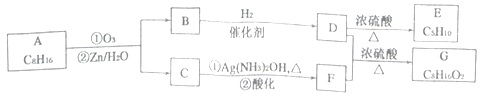
(1)B的分子式为_____________,D中含有官能团的名称________________。
(2)C→F中步骤①的化学反应方程式______________,该反应的反应类型是___________。
(3)B无银镜反应,D在浓硫酸存在下加热可得到能使溴水褪色且只有一种结构的物质E(不考虑立体异构),则A的结构简式为________________。
(4)G的同分异构体中,满足下列要求的结构有__________种(不考虑立体异构)。
①属于酯类;②酸性条件下水解能得到相对分子质量为74的有机物
(5)已知: ,请写出由C制备2—丙醇的合成路线_________________。
,请写出由C制备2—丙醇的合成路线_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种翠绿色晶体,在日光下照射,会因感光而部分变深蓝色,故常用于工程制图,即“蓝图”。K3[Fe(C2O4)3]·3H2O的制备反应为:2FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 = 2K3[Fe(C2O4)3]·3H2O。
回答下列问题:
(1)上述氧化过程中,Fe(II)_____(答简化电子排布式)变为Fe(III)______(答外围电子排布图),基态Fe(III)电子占据______个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为______。
(3)配合物K3[Fe(C2O4)3]的配位数为6,其配体C2O42—中的C的杂化方式为____杂化。
(4) H2O2属于______(填“极性”或“非极性”)分子。H2O2为二元弱酸,一级电离产物HO2—的立体构型是__________。H2O2沸点(150.2 ℃)比H2S沸点(-60.4 ℃)高,简要解释主要原因___________。
(5)将下列晶体的微粒配位数由大到小排序为________(填写代号)
① 金刚石;② 金属钾;③ 干冰
(6)FeO的晶胞结构为NaCl型,测知FeO晶胞边长为428pm,则此晶体中最近的Fe2+与Fe2+的距离为_________pm。(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10mL 0.2mol·L-l草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如右图关系,下列说法正确的是
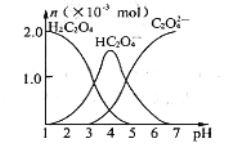
A. HC2O4-在溶液中水解程度大于电离程度
B. 当V (NaOH) =10 mL时溶液中存在:c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol·L-l
C. 当V (NaOH) =15mL时,溶液中存在:c(Na+)>c(HC2O4-)>c(C2O42-)>c (OH-)>c(H+)
D. 当V (NaOH) =20 mL时,溶液中存在:c(OH-) =c (HC2O4-)+c (H2C2O4)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )
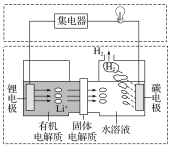
A.碳极发生的反应:2H2O+2e-=H2↑+2OH-
B.有机电解质和水溶液不可以互换区域
C.理论上外电路中每转移1 mol电子,负极消耗的质量为7 g
D.若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
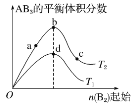
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO![]() +5HSO
+5HSO![]() +H+=2Mn2++5SO42-+3H2O
+H+=2Mn2++5SO42-+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A酸式滴定管(50 mL) B碱式滴定管(50 mL) C量筒(10 mL) D锥形瓶 E铁架台
F滴定管夹 G烧杯 H白纸 I胶头滴管 J漏斗
(2)不能用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因________________。
(3)选何种指示剂,说明理由____________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是( )
A.达到平衡时,X、Y的平衡转化率不同
B.升高温度,平衡常数K值增大
C.平衡常数K值越大,X的转化率越大
D.达到平衡时,反应速率v正(X)=2v逆(Z)
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是

A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量HCl溶液的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com