
科目: 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是重要的基础化工原料之一,是化学工业中最重要的产品,号称“工业之母”。在中学化学教材中有多处涉及其应用。
(1)利用浓硫酸配制稀硫酸
已知某浓硫酸的密度为1.84g/ml,质量分数为98%,则该浓硫酸的物质的量浓度为_______;
现用该浓硫酸配制480ml浓度为1.84mol/L的稀硫酸,在配制过程中除量取浓硫酸的仪器、烧杯、胶头滴管外,还需用到的玻璃仪器有______________________;
(2)硫酸与无机物的反应
实验室在用稀硫酸与锌反应制取氢气时,常向其中滴加少量硫酸铜溶液以加快反应速率,请写出发生的离子反应方程式______________________________;不活泼金属铜在与浓硫酸反应中,体现了浓硫酸的___________________性质;非金属碳在加热条件下也能与浓硫酸反应,若要你设计实验检验反应生成的气体产物,则检验出气体产物的正确顺序为______________________;
(3)硫酸在有机中的应用
利用硫酸的性质可以制取多种有机物,比如烈性炸药TNT、硝基化合物、酯类物质、不饱和烃等。请写出制取TNT的化学方程式________________________________________;请写出用乙醇制取乙烯的化学方程式________________________________________;稀硫酸还可以使蔗糖、淀粉等多种有机物发生水解,请写出蔗糖水解的产物名称_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
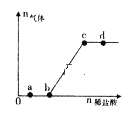
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目: 来源: 题型:
【题目】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为____________________________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为_______________________。
②沉淀器中反应的离子方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系:
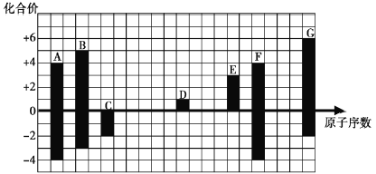
(1)元素A在周期表中的位置为________________________。
(2)用电子式表示D2G的形式过程:_________________________________________________,其所含化学键类型为__________。
(3)C2-、D+、G2-半径由大到小的顺序是________(填离子符号)。
(4)C、G的简单氢化物中,沸点较低的是________(填化学式),原因是________________。两种气态氢化物的稳定性C________G(填“>”或“<”)。
(5)C与D形成的具有强氧化性、可以做供氧剂的化合物的电子式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素氧化物)制备,工艺如下图所示。回答下列问题:
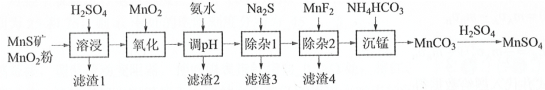
相关金属离子[c0(Mn+)=0.1 molL1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)写出“沉锰”的离子方程式_____________。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=__________。
时,z=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_____。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第一电离能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。
(3)FeF3具有较高的熔点(熔点高于1000℃),其化学键类型是__,FeBr3的式量大于FeF3,但其熔点只有200℃,原因是____。
(4)FeCl3可与KSCN、苯酚溶液发生显色反应。
①SCN-的三种元素中电负性最大的是____。
②苯酚(![]() )分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
)分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
(5)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com