
科目: 来源: 题型:
【题目】通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示,下列说法正确的是( )
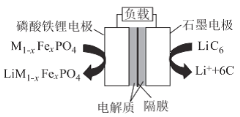
A.电池总反应为M1-xFexPO4+LiC6═LiM1-xFexPO4+6C
B.放电时,负极LiC6中碳元素失去电子变为单质
C.放电时,电流由石墨电极流向磷酸铁锂电极
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目: 来源: 题型:
【题目】通过FeCl3 溶液蒸干制得固体_________,原因是_____________________;继续灼烧产物是_____________ ,原因是 __________________________(离子方程式和文字说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX[X表示![]() 或
或![]() ]随pH的变化关系如图所示。下列说法不正确的是
]随pH的变化关系如图所示。下列说法不正确的是

A. 直线I中X表示的是![]()
B. 直线I、Ⅱ的斜率均为1
C. c(HC2O4-)>c(C2O42-)>c(H2C2O4)对应1.22<pH<4.19
D. c(Na+)=c(HC2O4-)+2c(C2O42-)对应pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3、KAl(SO4)2·12H2O等可作净水剂,原因是_____________、__________________(离子方程式和文字说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸铝(AlPO4)是一种用途广泛的材料,可在玻璃生产过程中充当助熔剂,作陶瓷或牙齿的黏合剂等。以磷硅渣[主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等]为原料制备磷酸铝的工艺流程如图所示:

请回答下列问题:
(1)浸渣中含有SiO2,试写出SiO2的一种重要用途__;酸浸中磷元素主要转化为H3PO4,该反应的化学方程式为__。
(2)生石灰除了调节pH外,另一作用是__。
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为__。
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是__(填化学式)。
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量w%的影响如图所示:

则最优反应条件是__。
(6)在物质的量浓度分别为0.01mol·L-1的CaCl2和AlCl3的混合溶液中加入等体积的Na3PO4溶液,若A13+恰好沉淀完全,即溶液中c(A13+)=1.0×10-5mol·L-1,此时AlPO4沉淀中__(填“是”或“否”)混有Ca3(PO4)2。[已知AlPO4、Ca3(PO4)2的Ksp分别为6.3×10-19、2.0×10-29]
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4-2H2O,M=180g.mol-1)为淡黄色固体,难溶于水,可用作电池正极材料磷酸铁锂的原料。回答下列问题:
实验1探究纯草酸亚铁晶体热分解产物
(1)气体产物成分的探究,设计如下装置(可重复选用)进行实验:
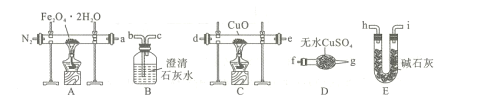
①装置B的名称为 ____。
②按照气流从左到右的方向,上述装置的连接顺序为a→___ →点燃(填仪器接口的字母编号)。
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是____。
④C处固体由黑变红,其后的澄清石灰水变浑浊,则证明气体产物中含有____。
(2)固体产物成分的探究,待固体热分解充分后,A处残留黑色固体。黑色固体可能是Fe或FeO,设计实验证明其成分为FeO的操作及现象为____。
(3)依据(1)和(2)结论,A处发生反应的化学方程式为____。
实验2草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的流程如下图:

(4)草酸亚铁晶体溶解酸化用KMnO4溶液滴定至终点的离子方程式为____。
(5)草酸亚铁晶体样品的纯度为 ____(用代数式表示),若配制溶液时Fe2+被氧化,则测定结果将____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)内因:___________________。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________,原因是_____________________________。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________,例如NaHCO3溶液显碱性,原因是_________________,_______________________________(离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________,_____________________(离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O![]() CH3COOH+OH-_______________
CH3COOH+OH-_______________
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | ||||
通入HCl | ||||
升温 | ||||
加水 | ||||
加NaOH | ||||
加HAc | ||||
加NH4Cl |
查看答案和解析>>
科目: 来源: 题型:
【题目】利奈唑胺(I)为细菌蛋白质合成抑制剂,其合成路线如下:
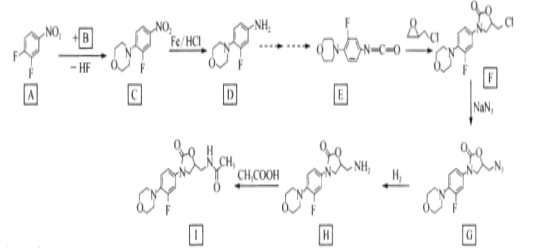
回答下列问题:
(1)A中的官能团名称是____,
(2)C—D、F—G的结反应类型分别为____
(3)B的结构简式为____。
(4)H—I的化学方程式为____。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出![]() 中的手性碳____
中的手性碳____
(6)芳香族化合物X是C的同分异构体,写出核磁共振氢谱有4组峰且峰面积比为4:4:2:1的X的结构简式____。(不考虑立体异构,只写一种)
(7)参照上述合成路线,设计以甲苯和乙酸为原料制备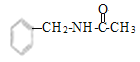 的合成路线(无机试剂任选)____。
的合成路线(无机试剂任选)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米磷化钴(CoP)常用于制作特种钻玻璃,制备磷化钴的常用流程如下:
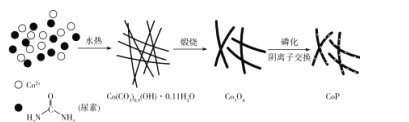
(l)基态P原子的价电子排布式为____,P位于元素周期表中____区。
(2)尿素中N原子的杂化类型是 _____;C、N、O三种元素的第一电离能最大的是____,电负性由小到大的顺序为____。
(3)Co(CO3)0.5(OH)·0.11H2O中CO32-中C的价层电子对数为____;该化合物中不含有的化学键有_____填标号)。
A 离子键 B 共价键 C 金属键 D 配位键 E 氢键 F 非极性键
(4)一些氧化物的熔点如下表所示:
![]()
解释表中氧化物之间熔点差异的原因____。
(5)CoP的晶胞结构如图所示,最近且相邻两个钴原子的距离为npm。
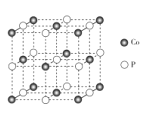
设NA为阿伏加德罗常数的值,则其晶胞密度为_______-g.cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究N2和H2直接合成NH3。在1.01×105Pa、250℃时,将1 molN2和1 molH2加入aL刚性容器中充分反应,测得NH3体积分数为0.04;其他条件不变,温度升高至450℃,测得NH3体积分数为0.025,则可判断合成氨反应为 ____填“吸热”或“放热”)反应。
(2)在1.01×105Pa、250℃时,将2 moIN2和2 molH2加入aL密闭容器中充分反应,H2平衡转化率可能为 ___(填标号)。
A =4% B <4% C 4%~7% D >11.5%
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
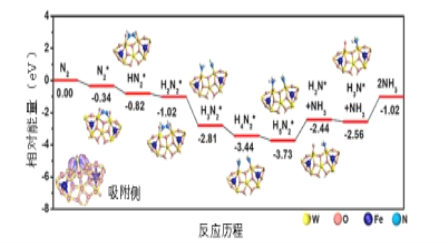
需要吸收能量最大的能垒(活化能)E=____ev,该步骤的化学方程式为____,若通入H2体积分数过大,可能造成 ___。
(4)T℃时,在恒温恒容的密闭条件下发生反应:![]() 反应过程中各物质浓度的变化曲线如图所示:
反应过程中各物质浓度的变化曲线如图所示:
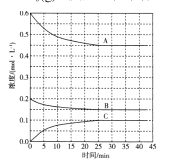
①表示N2浓度变化的曲线是 ____(填“A”、“B”或“C’,)。与(1)中的实验条件(1.01×105Pa、450℃)相比,改变的条件可能是_____。
②在0~25min内H2的平均反应速率为____。在该条件下反应的平衡常数为 ___mol-2.L2(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com