
科目: 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是

A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
查看答案和解析>>
科目: 来源: 题型:
【题目】用制溴苯的废催化剂(主要含FeBr3及少量溴、苯)为原料,制取无水FeCl3和溴的苯溶液,选用的方法能达到相应实验目的的是
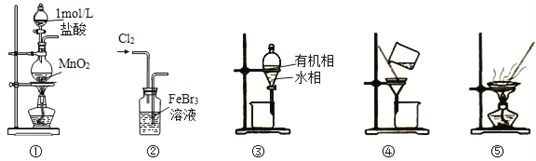
A. 用装置①及其试剂制取氯气
B. 用装置②氧化FeBr3溶液中的溴离子
C. 用装置③分离出FeCl3溶液,不能选用装置④分离
D. 用装置⑤将FeCl3溶液蒸发至干,可得无水FeCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )

A.HA的电离方程式为:HA=H++A- B.MOH为一元弱碱
C.K点对应的溶液中有:c(MOH)+c(M+)=0.02mol ![]() L-1 D.N点对应的溶液中有:c(M+)=c(A-)
L-1 D.N点对应的溶液中有:c(M+)=c(A-)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,则下列说法正确的是
A. 0.4mol AgNO3受热完全分解(2AgNO3![]() 2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.2NA
2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.2NA
B. 6.4g CaC2中含有的离子总数目为0.3NA
C. 1 mol FeI2与一定量氯气反应时,若已知有1mol Fe2+被氧化则转移的电子数为3NA
D. 1mol 苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O]是一种重要的还原剂,在空气中比一般的 亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
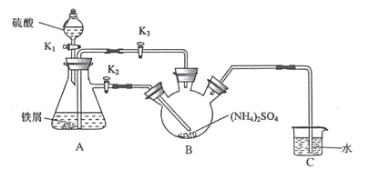
回答下列问题:
Ⅰ.制取莫尔盐
(1)连接装置,检査装置气密性。将 0.1mol(NH4)2SO4晶体置于玻璃仪器中 __填仪器 名称),将 6.0g 洁浄铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞 K3,打开 K2、K1,加完 55.0mL2mol·L-1 稀硫酸后关闭K1。
②待大部分铁粉溶解后,打开 K3、关闭 K2,此时可以看到的现象为__________;原因是____________。
③关闭活塞 K2、K3,采用 100℃水浴蒸发 B中水分,液面产生晶膜时,停止加热,冷却结晶、_______________、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的 pH 在 1~2 之间, 其目的为_______________。
④装置 C 的作用为 _____,装置 C 存在的缺点是_____。
Ⅱ.测定莫尔盐样品的纯度:取mg该样品配制成 1L 溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。
(1)已知:Cr2O72-还原产物为Cr3+,写出此反应的离子方程式_____。
(2)滴定时必须选用的仪器是_____。
①![]() ②
②![]() ③
③![]() ④
④ ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]()
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。[(NH4)2Fe(SO4)26H2O,Mr=392,BaSO4,Mr=233]
待测液→足量的 BaCl2 溶液→过滤→洗涤→干燥→称量→wg 固体
(3)莫尔盐晶体纯度为_____(用含 m、w 的式子表示,不用算出结果)。
(4)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
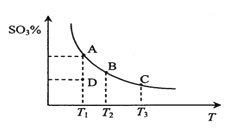
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物 K 是某药物的中间体,合成路线如图所示:
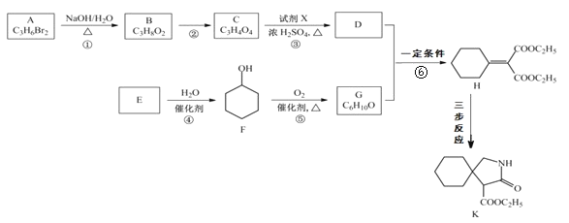
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】经过德国化学家哈伯、波施等的不懈努力,成功地开发了合成氨的生产工艺。如今 世界各国科学家为提高氨的产量,降低能耗做着各种有益的探索。试回答下列问题:
(1)已知NH3(l)NH3(g) △H1;N2(g)+3H2(g)2NH3(l) △H2 。则反应N2(g)+3H2(g)2NH3(g) 的△H=_______(用含 △H1、△H2的代数式表示)
(2)①在一定条件下,分别将 1mol N2和3mol H2置于恒压容器Ⅰ和恒容容器Ⅱ中 两容器起始容积相同充分反应,二者均达到平衡状态,则两容器中NH3 的体积分数是Ⅰ_______Ⅱ(填“>”、“<”或“=” 。)
②上述容积恒定的密闭容器中,达化学平衡状态时, 若NH3 的体积分数为10% ,若保持其他条 件不变,起始时改为充入2 mol N2和2molH2,达新平衡后,NH3的体积分数为_______10%填(“>”、“<”或“=”)。
(3)哈伯因证实 N2、H2 在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用![]() 分别表示 N2、H2、NH3 和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示:
分别表示 N2、H2、NH3 和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示:
![]()
①吸附后,能量状态最低的是___________填字母序号)。
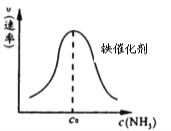
②由上述原理,在铁表面进行 NH3 的分解实验,发现分解速率与浓度关系如图。从吸附和解吸过程分析,c0前速率增加的原因可能是_________________________;c0 后速率降低的原因可能是___________________。
(4)已知液氨中存在:2NH3(l)NH2-+NH4+。用 Pt 电极对液氨进行电解也可产生 H2和 N2。阴极的电极反应式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com