
科目: 来源: 题型:
【题目】如图表示取1mol乙烯雌酚进行的4个实验,下列对实验数据的预测正确的是( )
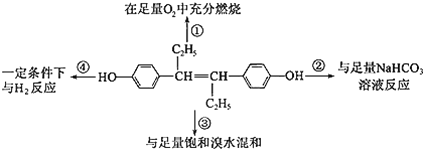
A.①中生成7 mol H2OB.②中生成2 mol CO2
C.③最多消耗3 mol Br2D.④中最多消耗7 mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各实验装置的叙述中,正确的是( )
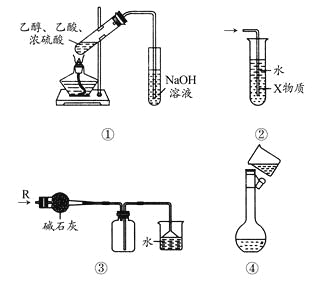
A.装置①制备乙酸乙酯
B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C.装置③可用于干燥、收集Cl2,并吸收多余的Cl2
D.装置④配制一定物质的量浓度的溶液时转移液体
查看答案和解析>>
科目: 来源: 题型:
【题目】β一l,3一葡聚糖具有明显的抗肿瘤功效,受到日益广泛的关注。β-l,3一葡聚糖的结构简式如图,下列说法正确的是

A.分子式为(C6Hl2O6)nB.与葡萄糖互为同系物
C.可以发生氧化反应D.葡萄糖发生加聚反应可生成β-l,3一葡聚糖
查看答案和解析>>
科目: 来源: 题型:
【题目】塑化剂DEHP的作用类似于人工荷尔蒙,会危害男性生殖能力并促使女性性早熟,长期大量摄取会导致肝癌.其毒性远高于三聚氰胺,会造成免疫力及生殖力下降.下列关于塑化剂邻苯二甲酸二正丁酯说法不正确的是( )
A.分子式为C16H22O4,可由石油化工原料通过取代,氧化,酯化反应制得
B.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
C.用核磁共振氢谱分析有6个吸收峰
D.邻苯二甲酸二正丁酯能发生加成,取代和氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B.5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C.4.6g C2H6O中含C-H键数为0.6NA
D.1L甲醛气体完全燃烧消耗O2的数目约为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:
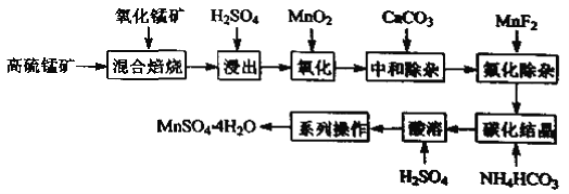
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
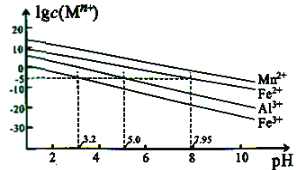
③此实验条件下Mn2+开始沉淀的pH为7.54;当离子浓度≤105mol·L1时,可认为离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为____。
(2)“氧化”时,发生反应的离子方程式为____。若省略“氧化”步骤,造成的后果是____。
(3)“中和除杂”时,生成沉淀的主要成分为____(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于____。(已知:Ksp(MgF2)=6.4×1010;Ksp(CaF2)=3.6×1012)
(5)“碳化结晶”时,发生反应的离子方程式为_____。
(6)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某驱虫剂(F)的合成路线如图:
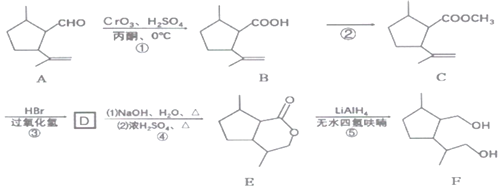
回答下列问题:
(1)E中官能团名称是______。
(2)碳原子上连有4个不同的原子或基团,该碳称为手性碳。则C中的手性碳原子有______个。
(3)反应①的反应类型是______。
(4)写出反应②的化学反应方程式______。
(5)写出D的结构简式______。
(6)已知芳香族化合物G比B少两个氢原子,G的核磁共振氢谱如图2,则G可能的结构简式为______。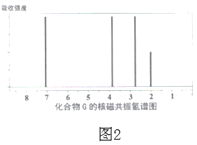
(7)设计由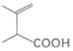 制备
制备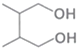 的合成路线。______(无机试剂任选)
的合成路线。______(无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】合理处理燃气中的H2S,不仅可减少对大气的污染,还可进行资源化利用。回答下列问题:
(1)H2S和S的燃烧热如表所示,
物质 | 燃烧热/△H(kJmol-1) |
H2S | -a |
S | -b |

请写出常温下H2S与SO2反应的热化学方程式______。
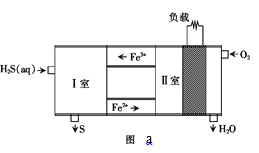
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是______;请写出 I室发生的离子方程式______。
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=______moL-1s-1;
②图b中,T1、T2、T3三个温度,最高的是______;比较A点与B点的逆反应速率的大小,vA(逆)______vB(逆)(填“>”、“<”或“=”);
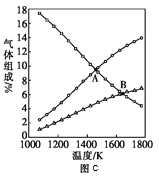
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=______;D点平衡时,H2S的转化率=______。
查看答案和解析>>
科目: 来源: 题型:
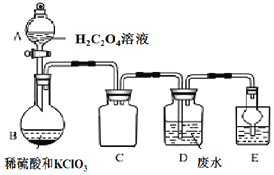
【题目】某工业废水中含有的 Mn2+、CN﹣等会对环境造成污染,在排放之前必须进行处理。ClO2是一种国际上公认的安全无毒的绿色水处理剂,某实验兴趣小组通过如图装置制备 ClO2,并用它来处理工业废水中的 Mn2+、CN﹣。
已知:i.ClO2 为黄绿色气体,极易溶于水,沸点 11℃;
ii.ClO2 易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低;
iii.某工业废水处理过程中 Mn2+转化为 MnO2、CN﹣转化为对大气无污染的气体;
iv.装置 B 中发生的反应为:H2C2O4+H2SO4+2KClO3═K2SO4+2CO2↑+2ClO2↑+2H2O。
请回答下列问题:
(1)B 装置的名称是_____,C 装置的作用为_____。
(2)用 H2C2O4 溶液、稀硫酸和 KC1O3 制备 ClO2 的最大优点是_____。
(3)写出装置 D 中除去 Mn2+的离子方程式_____。
(4)ClO2 在处理废水过程中可能会产生副产物亚氯酸盐(ClO2 )。下列试剂中,可将 ClO2 转化为 Cl
的是_____。(填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(5)在实验室里对该废水样品中 CN﹣含量进行测定:取工业废水Wg于锥形瓶中,加入10mL0.10mol/L 的硫酸溶液,用 0.0200mol/L 的 KMnO4标准溶液进行滴定,当达到终点时共消耗 KMnO4 标准溶液25.00mL。
在此过程中:
①实验中使用棕色滴定管的原因是_____,滴定终点的判断依据是_____。
②W g 工业废水中 CN﹣的物质的量为_____。
③若盛装工业废水的锥形瓶未润洗,则测定结果将_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com