
科目: 来源: 题型:
【题目】下列有关实验操作、实验现象和得出的结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将乙烯通入溴水中 | 溴水颜色褪去 | 乙烯具有还原性 |
B | 向5mL1mol·L-1的NaOH溶液中先滴入2滴1mol·L-1的MgCl2溶液,再滴入2滴1mol·L-1的FeCl3溶液 | 先有白色沉淀生成,后沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 向BaCl2溶液中同时通入NH3和SO2气体 | 无沉淀生成 | H2SO3不能和BaCl2反应生成BaSO3和HCl |
D | 向盛有KI3溶液的试管中加入苯和AgNO3溶液 | 溶液分层,上层溶液变紫红色,下层有黄色沉淀生成 | KI3溶液中存在平衡:I3- |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol/L的NH4Br溶液中通人适量氨气呈中性,此时溶液中NH4+的数目为NA
B.25 °C时,Ksp (BaCO3)=2.5×10-9 ,则BaCO3饱和溶液中Ba2+ 的浓度为5×10-5 mol/L
C.100g 17%双氧水中含有H原子的数目为NA
D.28g N2和CO的混合气体中含有的氧原子的数目为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(V)的关系如图所示,则下列说法正确的是( )
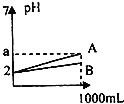
A.A、B两种酸溶液物质的量浓度一定相等
B.若a=5,则A是强酸,B是弱酸
C.稀释后A酸溶液的酸性比B酸溶液强
D.若a<5,则A.B都是弱酸且A的酸性>B
查看答案和解析>>
科目: 来源: 题型:
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以![]() -锂辉石为原料制备碳酸锂,其工艺流程如下:
-锂辉石为原料制备碳酸锂,其工艺流程如下:
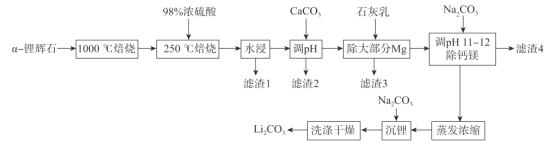
已知:①![]() -锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,
-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应, ![]() -锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
-锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
②β一锂辉石可与浓硫酸发生反应:2β一LiAl(SiO3)2+ H2SO4(浓)![]() Li2SO4 +Al2O3·4SiO2·H2O。
Li2SO4 +Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为_______,1000 °C焙烧![]() -锂辉石的目的为_____.
-锂辉石的目的为_____.
(2)滤渣2的主要成分为________调节pH值的范围为________。
(3)“除大部分Mg”步骤的离子方程式为______________。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、______________。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为________________________________。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiM1.5Ni0.5O4作为正极材料,以可传导Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-x Mn0.5Ni0.5O4 + Lix(CoP3 )![]() LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
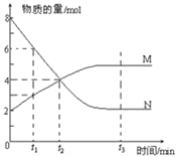
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目: 来源: 题型:
【题目】N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的[FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为__________,N-N键的键角为__________。
(2)基态砷原子的价电子排布图为__________,砷与同周期相邻元素的第一电离能由大到小的顺序为__________。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是__________(填"PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是__________。S-Cl键键长__________P-Cl键键长__________(填“>”、“=”或“<”),原因是__________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为__________。若该晶体的密度为ρgcm-3,设NA为阿伏加德罗常数的值,则a、b的距离为__________pm(用含ρ和NA的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】合成涤纶的流程图如下所示。
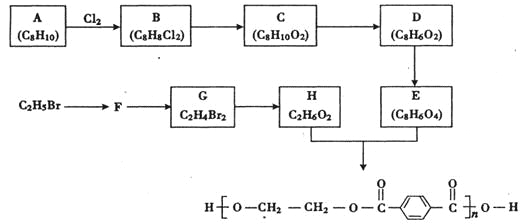
回答下列问题:
(1)A的名称为 ;
(2) F的结构简式是 ;
(3) C→D的反应类型是 ;F→G的反应类型为 ;
(4)E与H反应的化学方程式为 :
(5)E有多种同分异构体,符合下列条件的同分异构体有 种,其中在核磁共振氢谱中出现四组峰的是 (写出结构简式)。
①芳香族化合物;②红外光谱显示含有羧基;③能发生银镜反应;④能发生水解反应
(6) A也能一步转化生成E:![]() .试剂a可以用 溶液。
.试剂a可以用 溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知难溶电解质在水溶液中存在溶解平衡MmAn(s)![]() mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料(25℃):
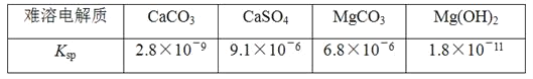
他们的实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入0.1mol·L-1的Na2SO4溶液100mL立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO33g,搅拌,静置后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④___________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越__(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式__。
(3)设计第③步的目的是什么__。
(4)请补充第④步操作及发生的现象__。
(5)请写出该转化在实际生活、生产中的一个应用__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com