
科目: 来源: 题型:
【题目】锰酸锂(LiMn2O4)是新型锂离子电池常用的正极材料。工业上以软锰矿浆为原料可制备锰酸锂,同时制得副产品MnSO4·H2O晶体,其流程如图所示。
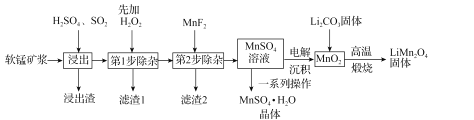
已知:(1)软锰矿浆的主要成分为MnO2,还含有Fe2O3,MgO、Al2O3,CaO,SiO2等杂质。
(2)温度高于27℃时,MnSO4晶体的溶解度随温度升高而逐渐降低。
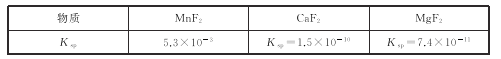
(3)有关物质的溶度积常数如下表:
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____。该过程中,为提高软锰矿中MnO2的浸出率,下列措施可行的有_____(填字母)。
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.适当升温
D.减少软锰矿浆的进入量
(2)第1步除杂中加入H2O2的目的是_____。
(3)第2步除杂,主要是将Ca2+,Mg2+转化为相应的氟化物沉淀除去,其中MnF2除去Mg2+反应的离子方程式为MnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s),该反应的平衡常数为_____。
(4)图中的一系列操作指的是_____。
(5)将MnO2和Li2CO3按4:1的物质的量之比配料,混合搅拌,然后高温煅烧600~750℃,制取产品LiMn2O4。写出该反应的化学方程式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为___________;
(2)等浓度的NaHCO3、Na2CO3混合溶液中的物料守恒表达式为____________;
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为__________;
(4) 泡沫灭火器灭火时发生反应的离子方程是______________。
(5)常温下,NaHSO3溶液中粒子浓度由大到小的顺序_________。
(6)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100 ℃的恒温。欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为________。(已知100℃,KW=1.0×10-12)
查看答案和解析>>
科目: 来源: 题型:
【题目】高聚物H是一种有机高分子材料,其合成路线如图所示:
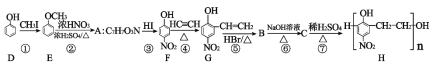
请回答下列问题:
(1)有机物D的名称是__________________,A的结构简式为_____________________;
(2)反应④的反应类型为________________;
(3)有机物F的核磁共振氢谱有____________组峰,峰面积之比为__________________;
(4)C到H的化学方程式为__________________________________________________;
(5)设计步骤①和步骤③的目的是_____________________________________________;
(6)满足下列条件的比G多一个O原子的有机物的同分异构体,有_____________种。
①能够发生银镜反应 ②含有硝基;
③能与FeCl3溶液发生显色反应; ④苯环上有三个取代基;
查看答案和解析>>
科目: 来源: 题型:
【题目】Cl2是一种重要的化工原料,也是一种剧毒气体。某化学兴趣小组制备Cl2并探究Cl2相关性质的过程如下。回答下列问题:
(1)氯气的制备
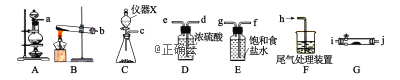
①上图中仪器X的名称是_________________,若用KMnO4和浓HCl反应制备Cl2则发生反应的化学方程式为_______________________________________________________;
②欲用二氧化锰和浓盐酸制备纯净干燥的Cl2,仪器接口的连接顺序为_______________;(根据气流方向,按照小写字母顺序填写)。
(2)制备的氯气与Fe粉在硬质玻璃管G中的反应,需采取________反应条件,将反应后的硬质玻璃管中固体溶于稀盐酸,取少量溶解后的溶液,检测其中金属阳离子种类:
实验编号 | 实验操作 | 实验现象 | 实验结论 |
① | 取少量待测液,滴加______溶液 | ____________ | 含有Fe2+ |
② | 取少量待测液,滴加______溶液 | ____________ | 含有Fe3+ |
查看答案和解析>>
科目: 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
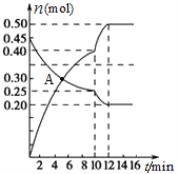
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目: 来源: 题型:
【题目】利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硒可防止人体因氧化而引起的衰老、组织硬化。回答下列问题:
(1)写出基态硒(Se)原子的价电子排布式____________;其中未成对电子数为_________;
(2)砷(As)和硒(Se)的第一电离能较大的是__________________;
(3)SeF2的立体构型为______________,Se原子的杂化方式为____________________;
(4)H2Se和H2O的熔沸点较高的是_________,原因是___________________________;
![]()
(5)Se和Zn组成的某种晶胞如图所示,则该晶体的化学式为________________,若已知该晶胞的密度为ρg/cm3,则该晶胞的棱长a=_______cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
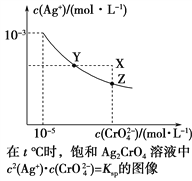
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列关于N及其化合物的问题:
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?_______,原因是__________________________________________。
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为_________________________________;该装置的负极原料为NH3,当电路中转移8mole-时,负极消耗NH3的质量理论值约为________,(保留小数点后一位小数)实际上消耗NH3的量远大于该理论值的原因可能为_________________________________________。
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为_____________________________。
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为_____价,酸性环境中的NaNO2可用H2O2氧化处理,处理过程的离子方程式为___________________,若改用O2来氧化,则68g的H2O2相当于O2的质量为____;(保留小数点后一位小数)使用H2O2作为氧化剂的优点是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com