
科目: 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率= _____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
III.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=____________。
(2)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向____________(填“正”、“逆”)反应方向移动。
(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
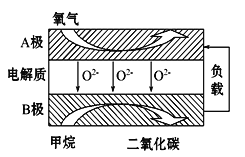
1)B极上的电极反应式为 。
2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
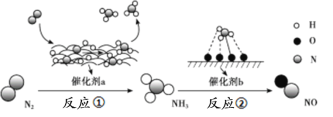

下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】现有室温下浓度均为![]() 的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③______⑥(填>、=、<),溶液中的离子浓度由大到小的顺序为________________。
(2)将等体积的①、⑤混合,则溶液的pH______7(填>、=、<),用离子方程式说明其原因____________________。
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为_____________,最终产生![]() 总量的关系为__________。
总量的关系为__________。
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的![]() 溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤_______⑥(填>、=、<)。
(6)将等体积的②、⑤混合,则溶液中浓度最大的离子是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸。常温下,向10 mL 0.01 mol·L-1的H2N2O2溶液中滴加0.01 mol·L-1的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是

A.由a点到n点水的电离程度依次增大
B.a点时,c(H2N2O2)>c(Na+)
C.m点时,c(OH-)+c(N2O22-)=c(H2N2O2)+c(H+)
D.m点到n点,![]() 比值不变
比值不变
查看答案和解析>>
科目: 来源: 题型:
【题目】元素Ni用途广泛,工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
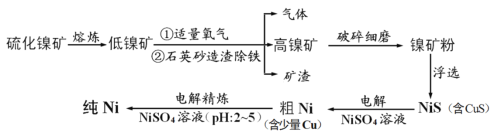
已知:①电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2 -2e-= 2H+ E=0.00V; Cu-2e- =Cu2+ E=0.34V;
Fe -2e-= Fe2+ E=-0.44V; Ni-2e-=Ni2+ E=-0.25V
②常温下溶度积常数 Ksp(NiS)=1.07×10-21; Ksp(CuS)=1.27×10-36
(1)可用光洁的镍丝代替铂丝蘸取化学试剂在焰色反应实验中灼烧,原因是_________。
(2)就制备高镍矿的相关问题请回答:
①通入氧气时控制适量的目的是________________。
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是__________________。
(3)电解制粗镍时阳极发生的主要电极反应式___________________。
(4)电解精炼镍的过程需控制pH为2~5,试分析原因__________________。
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+) 为0.107 mol/L,则滤液中残留的c(Cu2+)为________ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】查尔酮类化合物![]() (
(![]() )的一种合成路线如下:
)的一种合成路线如下:

已知:![]()
回答下列问题:
(1)![]() 的名称为_______,
的名称为_______,![]() 的官能团名称为_____________。
的官能团名称为_____________。
(2)![]() 的分子式为_____________________。
的分子式为_____________________。
(3)![]() 的反应类型为____________________。
的反应类型为____________________。
(4)![]() 的反应方程式为_________________。
的反应方程式为_________________。
(5)M是E的同分异构体,满足下列条件,其中核磁共振氢谱有4组吸收峰,峰面积之比为![]() 的结构为__________________。
的结构为__________________。
①能发生水解反应 ②遇![]() 显色
显色
(6)参照上述合成路线,写出用苯乙烯与苯甲醛为原料制备查尔酮(![]() )的合成路线(其他试剂任选)。________________
)的合成路线(其他试剂任选)。________________
查看答案和解析>>
科目: 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n≠p+q,温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
D.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 的生产、应用是一个国家化工水平的重要标志。
的生产、应用是一个国家化工水平的重要标志。
(1)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢![]() 的反应历程如下图所示:
的反应历程如下图所示:
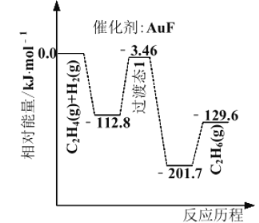
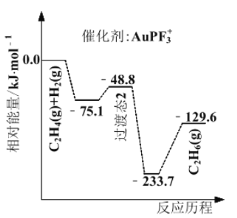
则![]() ____________,催化乙烯加氢效果较好的催化剂是________(选填“
____________,催化乙烯加氢效果较好的催化剂是________(选填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 经催化加氢合成乙烯:
经催化加氢合成乙烯:![]() 。恒容条件下,按
。恒容条件下,按![]() 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:
①指出图中曲线![]() 分别表示_______、________的浓度。
分别表示_______、________的浓度。
②升高温度,平衡常数![]() _________(“减小”“增大”或“不变”)。
_________(“减小”“增大”或“不变”)。![]() 点,
点,![]() ______(用
______(用![]() 表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。
表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。

(3)加州理工学院Theodor Agape等在强碱环境下,实现了电催化![]() 制
制![]() ,产物的选择性高达
,产物的选择性高达![]() ,
,![]() 转化为
转化为![]() 的电极反应式为___________________。
的电极反应式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向![]() 未知浓度的
未知浓度的![]() 、
、![]() 混合溶液逐滴滴加
混合溶液逐滴滴加![]() 溶液,混合溶液的电导率(导电能力)如图所示,下列叙述错误的是( )
溶液,混合溶液的电导率(导电能力)如图所示,下列叙述错误的是( )

A.![]() 两点水的电离程度:
两点水的电离程度:![]()
B.原溶液中![]()
C.![]() 是
是![]() 恰好被
恰好被![]() 溶液中和的过程
溶液中和的过程
D.![]() 点:
点:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向容积可变的密闭容器中充入醋酸的二聚物![]() ,发生反应:
,发生反应:![]() 。测得平衡时混合气体的平均摩尔质量
。测得平衡时混合气体的平均摩尔质量![]() 与温度
与温度![]() 、压强
、压强![]() 的关系如图所示。下列有关说法错误的是( )
的关系如图所示。下列有关说法错误的是( )
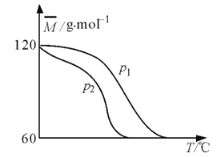
A.![]()
B.当![]() 时,平衡常数
时,平衡常数![]()
C.保持温度不变,增大压强,平衡左移,![]() 增大
增大
D.![]() 条件下,保持温度不变,向容器中加入少量
条件下,保持温度不变,向容器中加入少量![]() ,
,![]() 平衡转化率增大
平衡转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com