
科目: 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目: 来源: 题型:
【题目】水溶液X中只可能含有K+、Mg2+、Al3+、AlO2—、SiO32—、SO32—、CO32—、SO42—中的若干种离子。某同学对该溶液X进行了如下实验;下列判断正确的是( )
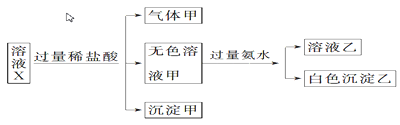
A. 气体甲一定是纯净物
B. K+、AlO2—和SiO32—一定存在于溶液X中
C. 沉淀甲是硅酸和硅酸镁的混合物
D. 凭以上实验能确定SO42—是否存在于溶液X中
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
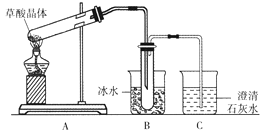
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0molL-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体。同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_________________________________________,产物中的单质是___________。
(2)②中所发生的各反应的化学方程式是_______________________________________。
(3)③中所发生的各反应的离子方程式是 _________________________。
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为 _______________。c(Fe2+)为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是( )
阳离子 | 阴离子 |
Na+、Fe3+、Fe2+、Mg2+ | NO3-、HCO3-、CO32-、SO42-、Cl- |
A.X溶液中一定含Fe3+、Fe2+
B.X溶液中不可能含有HCO3-或CO32-
C.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O
D.根据电荷守恒,原溶液中一定含Mg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:

(1)正四面体烷的分子式为________________,其二氯取代产物有_________种;
(2)关于乙烯基乙炔分子的说法错误的是:________。
a、能使酸性KMnO4溶液褪色
b、1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c、生成乙烯基乙炔分子的反应属于取代反应
d、等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:________________;
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例): ________、________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
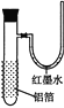
A.铝与硝酸汞反应属放热反应
B.铝是一种较活泼的金属,
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)生成物A的电子式为:__________________,属于______________晶体。
(2)黑火药中位于短周期的元素有_________种。其中有一种元素的单质可制药,其氧化物可做防腐剂,该元素在周期表中的位置是_________,该元素的原子核外有_______种不同运动状态的电子。
(3)黑火药所含元素中原子半径从大到小的顺序是______________(用元素符号表示);
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有___________________。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
查看答案和解析>>
科目: 来源: 题型:
【题目】电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是_________(用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是_____________(用元素符号表示);
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态______________;
(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;
(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
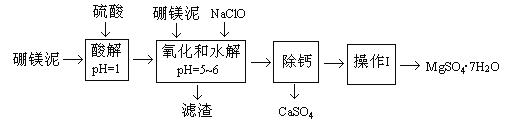
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com