
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________。
(2)装置A中发生反应的化学方程式为__________________________________。实验结束后,将B瓶中的溶液经蒸发浓缩、__________(填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________,其中盛放的药品为 ____________(填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】烯烃和酚类是两种重要的有机化工原料。完成下列填空:
(1)合成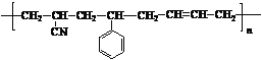 除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式________________________________、_________________________________。
除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式________________________________、_________________________________。
(2)由苯乙烯合成(![]() )需要三步,第一步选用的试剂为__________,目的是______________________________。
)需要三步,第一步选用的试剂为__________,目的是______________________________。
(3)邻甲基苯酚可合成A,分子式为C7H6O3,在一定条件下A自身能缩聚成B。B的结构简式_________。A与浓溴水反应的化学方程式为_________________。
(4)设计一条由![]() 制备A的合成路线(合成路线常用的表示方法为:M
制备A的合成路线(合成路线常用的表示方法为:M![]() N……
N……![]() 目标产物)____________________。
目标产物)____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
(1)一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重___克。
(2)常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400mLpH=14的溶液,则产生的气体标准状况下体积为___L。
(3)在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。此时生成标准状况下气体体积为5.6L。则原混合液中c(SO42-)=___mol/L。
(4)取17.88gNaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为15.92g。请列式计算:
①求原混合物中Na2O2的质量B___;
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升___?
查看答案和解析>>
科目: 来源: 题型:
【题目】摩尔盐在工业上有重要的用途。已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成。步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:
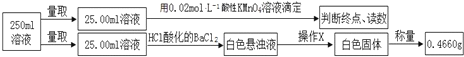
滴定实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
完成下列填空:
(1)步骤①中需要的定量仪器为________________ 、__________________。
(2)步骤②的目的是_____________________________________________________。产生红褐色沉淀的离子方程式_____________________________________。
(3)步骤④中操作X为_________________________________(按操作顺序填写)。
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,_______(填“能”或“不能”),请说明理由__________________________________________________。
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将__________。(选填“ 偏大”、“偏小”或“不变”)。
(6)通过上述实验测定结果,推断摩尔盐化学式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
Ⅰ直接脱硝
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为___mol/(Lmin)。

Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为___。
Ⅲ氨气脱硝
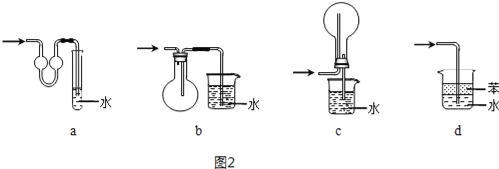
(3)实验室制取纯净的氨气,除了氯化铵外,还需要___、___(填写试剂名称)。不使用碳酸铵的原因是___(用化学方程式表示)。
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是___。
NH3脱除烟气中NO的原理如图3:
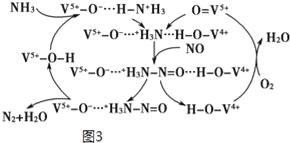
(5)该脱硝原理中,NO最终转化为___(填化学式)和H2O。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为___L。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氟酸可用于半导体工业,也常用来蚀刻玻璃,其刻蚀反应原理如下:6HF+Na2SiO3→2NaF+SiF4↑+3H2O
完成下列填空:
(1)根据HF的___(选填编号)大于H2O,可推断氟元素的非金属性强于氧元素。
a.酸性 b.熔沸点 c.稳定性 d.键的极性
(2)SiF4与甲烷结构相似,SiF4是含___键的___分子(均选填“极性”或“非极性”)。刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物,该化合物的电子式为___。
(3)Si原子核外电子有___种不同能量的电子,其中最高能量的电子处于___轨道。
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,两个反应原理相似,但前者的反应速率明显大于后者。原因是___。
(5)同浓度的H2SO3和HF两溶液的pH为:H2SO3___HF(选填“>”或“<”)。浓度均为0.01mol/L的H2SO3和HF的1L混合溶液中,通入0.02molNH3充分反应后,SO32-、HSO3-、F-、NH4+浓度从大到小的顺序为:___。
已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7;HF Ki=6.8×10-4;NH3H2O Ki=1.8×10-5。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热一段时间后,溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.n(Na+)∶n(Cl-)可能为7∶3
B.与NaOH反应的氯气一定为0.3mol
C.当转移电子为n mol时,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为6∶1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】I:氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O ,已知Cu2O(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的方程式:__________________________________.
(2)反应中硝酸体现了____________、__________性质.
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是__________.
II:现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3- + Br2;请回答下列问题:
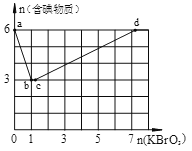
(4)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式______。
(5)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为___________mol。
(6)n(KBrO3)=4时,对应含碘物质的化学式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是( )
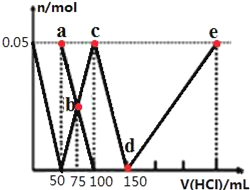
A.原混合溶液中的n(CO32-):n(AlO2-)=1:1
B.a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C.b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
D.d→e的过程中水的电离程度逐渐减小
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)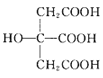 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
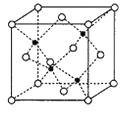
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com