
科目: 来源: 题型:
【题目】改变0.1 mol·L-1己二酸(简写为H2A,电离常数分别为Ka1、Ka2)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是

A.Ka1=10-4.4
B.曲线II表示的是HA-的物质的最分数δ(X)肋pH的变化关系
C.NaHA溶液中:c(H+)=c(OH-)+2c(A2-)-c(H2A)
D.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物电化学技术作为一种新型水处理工艺,因具有污染物同步去除和能源化的特点而受到广泛关注。一种典型的乙酸降解微生物电化学系统(MES)工作原理如下图所示。下列说法错误的是
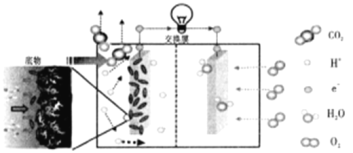
A.MES系统中的交换膜为阳离子交换膜
B.乙酸降解过程中,若电路中流过2 mol电子,则理论上右室需要通入O2约11.2L
C.通入O2的一极为正极,发生还原反应
D.逸出CO2的一侧电极反应式为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.1 L 1mol·L-1的NH4Fe(SO4)2溶液中,Fe3+数目与SO42-数目之比为1:2
B.标况下,22.4 L NO2与足量水反应生成0.5NA个NO分子
C.1 mol石墨和金刚石的混合物中,含碳碳键数目为4NA
D.K37ClO3+6H35Cl=3Cl2↑+KCl+3H2O若该反应转移5NA个电子,则生成212 g Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,且X、Z是同族元素,W元素的单质为淡黄色固体。它们的最高价氧化物溶于水可得四种溶液,0.010mol·L-1的这四种溶液pH与该元素原子半径的关系如右图所示。下列说法正确的是

A. W的氧化物的水化物一定是强酸
B. 气态氢化物的稳定性:Z>X
C. 简单离子半径:W>Y
D. Y与W形成的化合物一定含有共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
A.c(H+)随着温度的升高而降低
B.在35 ℃ 的纯水中时,c(H+)>c(OH)
C.水的电离常数Kw(25℃)>Kw(35℃)
D.水的电离是一个吸热过程
查看答案和解析>>
科目: 来源: 题型:
【题目】下列水解反应的离子方程式书写正确的是
A.Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Cl+H2O![]() HCl+OH
HCl+OH
C.CO32-+2H2O![]() H2CO3+2OH
H2CO3+2OH
D.NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,恒容密闭容器中,可逆反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A.混合气体的压强不再变化B.混合气体的颜色不再变化
C.反应速率v(H2)=0.5v (HI)D.c(H2):c(I2):c(HI)=1:1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镓是由门捷列夫第一个预言成真的元素,有“电子工业脊梁”的美誉,它与铝同主族,其氧化物和氢氧化物均为两性化合物,镓及其化合物应用广泛。粉煤灰中可以提取镓,粉煤灰中的主要成分为Ga2O3,含CaO、SiO2、Al2O3等杂质。镓的熔点较低(29.8℃).沸点很高(2403℃)。
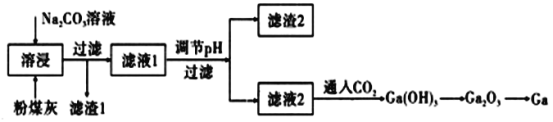
(1)滤渣1的主要成分为:___________。
(2)为了提高溶浸效率可以采用的措施有(写两种):____________。
(3)写出镓单质与氢氧化钠溶液反应的离子方程式:___________。
(4)其他镓的化合物在生活和前沿科技上有广泛应用,根据已学知识回答下列问题:
①GaCl3溶液制备GaCl3固体,应如何操作:_________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每消耗1 mol Ga时放出15.135 kJ热量。该可逆反应的热化学方程式是______。
(5)下表是两种两性氢氧化物的电离常数。

将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是____。
(6)电解法可以提纯粗镓(内含Zn、Fe、Cu等杂质),以NaOH水溶液为电解质,在阴极析出高纯度的镓,请写出阴极电极反应:_____(离子氧化顺序为:Zn2+<Ga3+<Fe2+)。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:
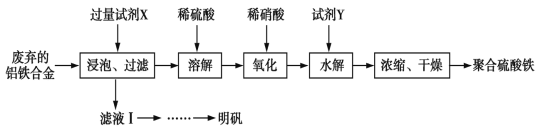
已知:聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
(1)在聚合硫酸铁中,x、y之间的关系是_______________。试剂X中溶质的化学式为______。
(2)写出上述流程图中的“氧化”的离子方程式:______________该设计存在缺陷,请提出改进意见;________
(3)加入试剂Y的目的是为了调节溶液的pH,若Y为氧化物,写出调节pH的离子方程式:_____
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2 的混合溶液中加入碱液,要使Fe3+ 刚好完全沉淀的pH为____,而Mg2+刚好开始要沉淀的pH为__________。(已知lg 2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com