
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中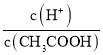 减小
减小
B.CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中![]() 增大
增大
D.向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中![]() 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将1.0 mol·L-1的氨水滴入10 mL1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
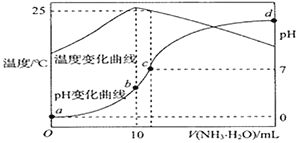
A.KW的比较:a点>b点
B.水的电离程度:a>b>c>d
C.b点时溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c点时溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
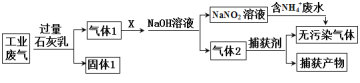
下列说法不正确的是
A.X可以是过量的空气
B.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+ 废水,每产生1mol无污染气体转移3NA电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法对应的离子方程式合理的是
A.纯碱溶液去油污:CO32-+H2O==HCO3-+OH-
B.泡沫灭火器工作原理:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
C.铝溶于烧碱溶液:Al+2OH-==AlO2-+H2↑
D.用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2H2O-2e-==PbO2+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是

A. 该反应是吸热反应
B. 使用催化剂后反应热减小
C. 热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
查看答案和解析>>
科目: 来源: 题型:
【题目】环已醇被高锰酸钾“氧化”发生的主要反应为![]() KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
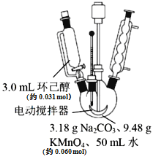
A.“氧化”过程应采用热水浴加热
B.装置中用到的球形冷凝管也可以用于蒸馏分离实验
C.滴加环己醇时不需要打开恒压滴液漏斗上端活塞
D.在滤纸上点1滴反应后混合物,未出现紫红色,则反应已经完成
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN-
B.使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO4-
C.由水电离出的c(H+)=10-12mol·L-1的溶液:Na+、K+、CO32-、SO42-
D.![]() =10-12的溶液中:Mg2+、Al3+、NO3-、SO42-
=10-12的溶液中:Mg2+、Al3+、NO3-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
下列说法正确的是
A.CO2晶胞为分子密堆积,配位数为12B.AlF63-中Al3+为配体,接受孤电子对
C.CO32- 和CO2中C的杂化方式相同D.分子间氢键:HF大于H2O,HF的熔沸点高
查看答案和解析>>
科目: 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
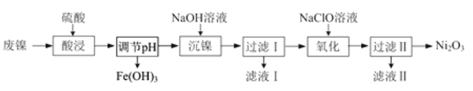
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有_____________(任写出一条)。
(2)“酸浸”时Fe2O3发生反应的离子方程式:____________________________________。
(3)“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于__________ [已知Fe(OH)3的Ksp=4×10-38,![]() ≈1.6 ]。
≈1.6 ]。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是_____________________________________。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:____________________。
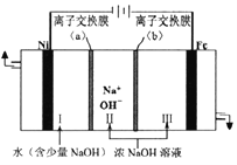
(6)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的![]() 。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com