
科目: 来源: 题型:
【题目】聚酰胺-66是含有肽键的高分子化合物,常用于生产帐篷、渔网等。可用以下方法合成:
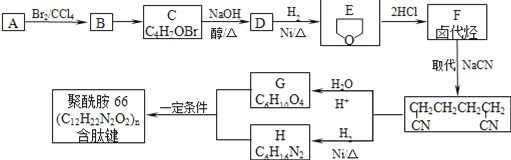
已知:A与E互为同分异构体,完成下列填空:
(1)A→B的反应类型______,A中含氧官能团的名称______
(2)B的结构简式______,D可能的结构简式______
(3)F与氢氧化钠的乙醇溶液共热得到烃I,I的名称______。比I多一个碳原子的同系物,与等物质的量溴反应生成二溴代物的结构简式正确的是______
a.![]()
b.![]()
c.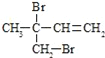
d.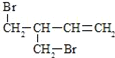
(4)G和H反应生成聚酰胺-66的化学方程式:______
(5)同时满足下列条件的G的同分异构体的结构简式为______
①含一种官能团 ②能发生银镜反应 ③含甲基且有三种化学环境不同的氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
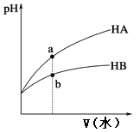
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式______
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:____Mn2++____S2O82﹣+____H2O→____MnO4﹣+____SO42﹣+______H+。配平该反应方程式,氧化产物是______
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在______(填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到______g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中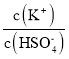 ____(填:“增大”、“减小”或“不变”)
____(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7,NH4++H2ONH3H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是____(选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3H2O+SO32﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13。下列说法不正确的是( )

A.在t℃时,AgI的Ksp=2.5×10-15 mol2.L-2
B.图中b点有碘化银晶体析出
C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点
D.在t℃时,反应AgBr(s)+I-(aq)![]() AgI(s)+Br-(aq)的平衡常数K=200
AgI(s)+Br-(aq)的平衡常数K=200
查看答案和解析>>
科目: 来源: 题型:
【题目】现代化学测定有机物组成及结构的分析方法较多。下列有关说法正确的是
A.元素分析仪不仅可以测出试样常见的组成元素及含量,还可以测定其分子的空间结构
B.![]()
C.通过红外线光谱图分析可以区分乙醇和乙酸乙酯
D.质谱法和紫外光谱法不属于测定有机物组成和结构的现代分析方法
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c.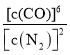 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
查看答案和解析>>
科目: 来源: 题型:
【题目】现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol。则原混合气体中氢气的物质的量可能是( )
A.0.03molB.0.04molC.0.05molD.0.06mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
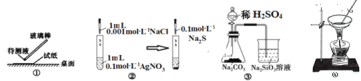
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 增大
增大
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中所得溶液中c(Cl-)=c(I-)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com