
科目: 来源: 题型:
【题目】向含有下列微粒的溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使该微粒浓度下降的是
A.Fe3+B.HS—C. D.C6H5O—
D.C6H5O—
查看答案和解析>>
科目: 来源: 题型:
【题目】在加热固体NH4Al(SO4)212H2O时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4)3,下列判断正确的是( )
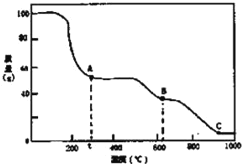
A.0℃→t℃的过程变化是物理变化
B.C点物质是工业上冶炼铝的原料
C.A→B反应中生成物只有Al2(SO4)3和NH3两种
D.Al2(SO4)3能够净水,其原理为:Al3++3OH-![]() Al(OH)3
Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:

下列说法正确的是
A. 离子半径的大小顺序:e>f>g>h
B. 与x形成简单化合物的沸点:y>z>d
C. x、z、d三种元素形成的化合物可能含有离子键
D. e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】关键环节考核:
(1)将AgNO2和AgCl的饱和溶液等体积混合后,加入足量的硝酸银溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。(已知该温度下,Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10)
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________________。
学法题:通过上题第(2)问的计算,请思考利用溶度积常数(Ksp)进行定量计算,代入离子浓度时需要注意的关键是什么?__________
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图装置进行实验;下列预期实验现象及相应结论均正确的是( )
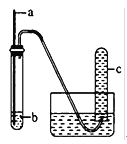
a | b | 预期实验现象 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】方法与规律提炼:
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
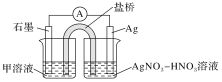
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是_________________________
(2)用零价铁(Fe)去除水体中的硝酸盐(NO![]() )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
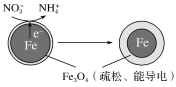
上图中作负极的物质是___________。正极的电极反应式是______________。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。 电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
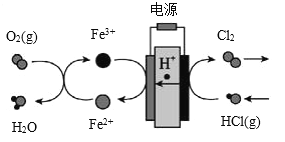
(4)KClO3也可采用“电解法”制备,装置如图所示。
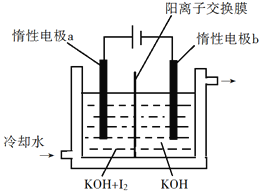
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:

下列说法不正确的是( )
A. x为NaOH溶液,y为盐酸
B. a→b发生的反应为:AlO2-+H++H2O═Al(OH)3↓
C. b→c→Al的反应条件分别为:加热、电解
D. a、b、c既能与酸又能与碱反应
查看答案和解析>>
科目: 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】信息筛选:
Ⅰ.某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
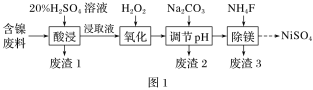
已知:①SiO2不溶于稀硫酸。
②Ksp(MgF2)=7.4×10-11。
③有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
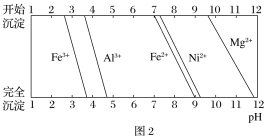
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是_______________(填化学式)。
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理加以解释:___(用必要的文字和离子方程式回答)。
(3)已知沉淀前溶液中c(Mg2+)=1.85×10-3 mol·L-1,当除镁率达到99%时,溶液中c(F-)=_________mol·L-1。
(4)在NaOH溶液中用NaClO与NiSO4反应可制得NiO(OH),化学方程式为______。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。实验室可通过滴定的方法测定所制硝酸银样品的纯度(杂质不参与反应),测定过程如下,已知:Ag++SCN-=AgSCN↓(白色)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。溶液配制过程 中所用的玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(2)准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100mol·L-1NH4SCN标准溶液滴定。滴定终点的实验现象为__________。
(3)若滴定前滴定管尖嘴处有气泡,滴定过程中该气泡消失,则所测硝酸银的质量分数________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com