
科目: 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】分类是重要的科学研究方法,下列物质分类正确的是
A.酸性氧化物:SO2、SiO2、NO2
B.弱电解质:CH3COOH、BaCO3、Fe(OH)3
C.纯净物:铝热剂、漂粉精、聚乙烯
D.无机物:CaC2、石墨烯、HCN
查看答案和解析>>
科目: 来源: 题型:
【题目】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。
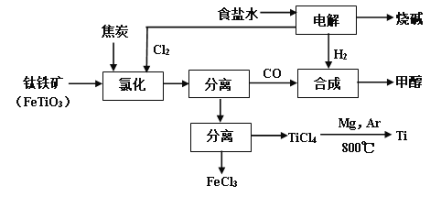
已知:合成甲醇的主反应为:CO+2H2![]() CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2![]() C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2![]() C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________(填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________。
(3)诸如上述联合生产,其优点有_______。生产中除了获得上述目标产品外,还能得到副产品________(填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2 _____吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
物质 | 沸点(0C) |
TiCl4 | 136 |
FeCl3 | 315 |
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)沼气是一种能源,它的主要成分是CH4,常温下,0.5molCH4完全燃烧生成CO2(g)和液态水时,放出445kJ热量,则热化学方程式为__。
(2)已知:![]() N2(g)+
N2(g)+![]() H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1
H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1
N(g)+3H(g)=NH3(g) ΔH2=-bkJ·mol-1
NH3(g)=NH3(l) ΔH3=-ckJ·mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式__。
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在某一容积为2L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:
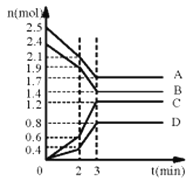
回答下列问题:
①该反应的化学方程式为___。
②前2min用A的浓度变化表示的化学反应速率为__。在2min时,图像发生改变的原因可能是__(填字母)。
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | a | b | c |
c(NO2)/mol·L-1 | 0.000 | 0.060 | d | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式__,达到平衡时N2O4的转化率为__。
②在0~20s内,四氧化二氮的平均反应速率为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如图:
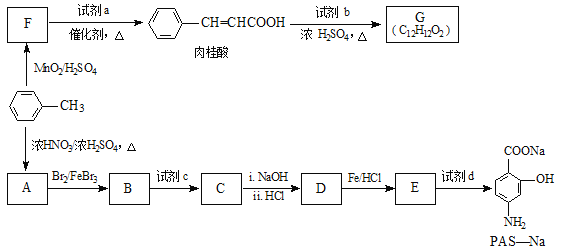
已知:
①![]()
②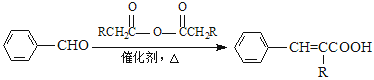 (R=—CH3或—H)
(R=—CH3或—H)
③![]()
回答下列问题:
(1)![]() 生成A的反应类型是___。
生成A的反应类型是___。
(2)F中含氧官能团的名称是___,试剂a的结构简式为___。
(3)写出由A生成B的化学方程式:___。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:___。
(5)当试剂d过量时,可以选用的试剂d是___(填字母序号)。
a.NaHCO3 b.NaOH c.Na2CO3
(6)肉桂酸有多种同分异构体,写出符合下列条件的任意一种的结构简式___。
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物最多生成4molAg;
c.苯环上有两种不同化学环境氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组以乙烯等为主要原料合成药物普鲁卡因:
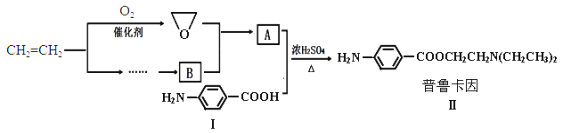
已知:![]() ,
,![]()
(1)对于普鲁卡因,下列说法正确的是___。
a.一个分子中有11个碳原子
b.不与氢气发生加成反应
c.可发生水解反应
(2)化合物Ⅰ的分子式为___,1mol化合物Ⅰ能与___molH2恰好完全反应。
(3)化合物Ⅰ在浓H2SO4和加热的条件下,自身能反应生成高分子聚合物Ⅲ,写出Ⅲ的结构简式___。
(4)请用化学反应方程式表示以乙烯为原料制备B(无机试剂任选)的有关反应,并指出所属的反应类型___。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定工业纯碱中Na2CO3的质量分数(含少量NaCl),甲、乙、丙三位学生分别设计了一套实验方案。
学生甲的实验流程如图所示:
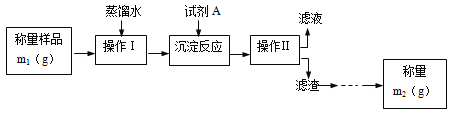
学生乙设计的实验步骤如下:
①称取样品,为1.150g;②溶解后配成250mL溶液;③取20mL上述溶液,加入甲基橙2~3滴;④用0.1140mol/L的标准盐酸进行滴定;⑤数据处理。
回答下列问题:
(1)甲学生设计的定量测定方法的名称是___法。
(2)试剂A可以选用___(填编号)
a.CaCl2 b.BaCl2 c.AgNO3
(3)操作Ⅱ后还应对滤渣依次进行①___、②___两个实验操作步骤。其中,证明前面一步的操作已经完成的方法是___;
(4)学生乙某次实验开始滴定时,盐酸溶液的刻度在0.00mL处,当滴至试剂B由___色至___时,盐酸溶液的刻度在14.90mL处,乙同学以该次实验数据计算此样品中Na2CO3的质量分数是___(保留两位小数)。乙同学的这次实验结果与老师给出的理论值非常接近,但老师最终认定他的实验方案设计不合格,你认为可能的原因是什么?___。
(5)学生丙称取一定质量的样品后,只加入足量未知浓度盐酸,经过一定步骤的实验后也测出了结果。他的实验需要直接测定的数据是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学利用如图所示实验装置进行某些气体的制备、物质性质的探究等实验(图中夹持装置省略)。
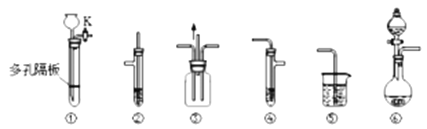
请按要求填空:
(1)实验室制取SO2气体时,可选择的合适试剂___(选填编号)。
a.15%的H2SO4溶液 b.75%的H2SO4溶液 c.Na2SO3固体 d.CaSO3固体
相应的制取装置是___(填图中装置下方编号)。
(2)实验室若用装置①来制取H2S气体,可选择的固体反应物是___(选填编号)。
a.Na2S固体 b.CuS固体 c.FeS固体 d.FeS2固体
反应的离子方程式为___。
(3)如何检验装置①的气密性?简述其操作:___。
(4)实验室里可用浓硫酸和无水酒精反应制取乙烯,除了题中的仪器外,制取装置中还缺少的玻璃仪器是___。
(5)该化学兴趣小组为探究制备乙烯是否存在副产物SO2和CO2,制备的气体从发生装置出来除去乙烯后依次选择了装置②、④、⑤,其中装置②盛有的试剂是___,装置④盛有的试剂是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】三位化学家因研究锂电池做出开创性贡献而获得2019年诺贝尔化学奖。磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点;成为目前广泛使用的锂电池。
(1)铁元素在元素周期表中的位置__;LiFePO4中Fe2+基态电子排布式是__。
(2)P的电负性___O的电负性(填写“大于”“小于”或“等于”);PO43-的空间构型是__,中心原子的杂化方式是___。
(3)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是__。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为__,其中Fe的配位数为__。
(5)有一种蓝色晶体[可表示为:KFex(CN)6,相对分子质量为Mr],经研究发现,其晶胞的![]() 如图所示(K+未画出)。
如图所示(K+未画出)。
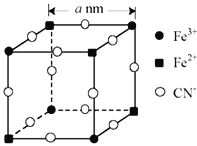
①晶体中与每个Fe3+距离最近且等距离的CN-有__个。
②该晶体的化学式为__。
③若晶胞中每个Fe3+和Fe2+距离用anm表示,则晶体的密度表达式是__g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com