
科目: 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,Ca(OH)2在水溶液中达到溶解平衡:![]() 。下列叙述正确的是
。下列叙述正确的是
A.加入少量氢氧化钠固体,Ca(OH)2溶解平衡向左移动,溶液中c(H+)减小
B.加水,Ca(OH)2的溶解平衡向右移动,pH增大
C.加入少量盐酸,Ca(OH)2溶解平衡向右移动Ksp[Ca(OH)2]增大
D.升高温度,Ca(OH)2溶解平衡向右移动,Ksp[Ca(OH)2]增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中存在反应![]() ,当加入CaCO3固体后,溶液颜色变浅
,当加入CaCO3固体后,溶液颜色变浅
B.分别用等体积的蒸馏水和0.010mol·L-1硫酸洗涤BaSO4沉淀,后者损失的BaSO4沉淀较少
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.合成氨工业中新发明的钌基催化剂的催化作用优于传统的铁催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】氢溴酸是无色、易挥发的液体,在化工领域用途广泛。实验室模拟一种工业制备氢溴酸的主要流程如下:
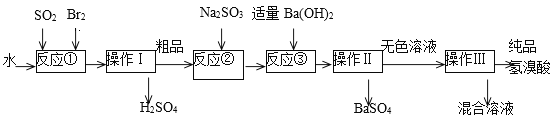
(1)写出反应①的离子方程式___________该反应需要在冰水浴中进行,可能的原因是____________。
(2)操作I的名称__________。
(3)反应②中Na2SO3的目的是_____________________。
(4)操作Ⅱ用到的玻璃仪器有烧杯、_____________________。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_________,若假设成立可观察到的现象为____________________。
②乙同学假设工业氢溴酸呈淡黄色是因为____,其用于证明该假设成立的方法为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物N的结构中含有三个六元环,其合成路线如下。

已知:RCH=CH2+CH2=CHR′![]() CH2=CH2+RCH=CHR′
CH2=CH2+RCH=CHR′
请回答下列问题:
(1)F分子中含氧官能团的名称为_______。B的结构简式为____________。
(2)G→H的化学方程式______________。其反应类型为_____。
(3)D在一定条件下能合成高分子化合物,该反应的化学方程式____________。
(4)A 在5000C和Cl2存在下生成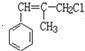 ,而不是
,而不是![]() 或
或 的原因是_________。
的原因是_________。
(5)E的同分异构体中能使FeCl3溶液显色的有_______种。
(6)N的结构简式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H是一种氨基酸,其合成路线如下:

已知:
①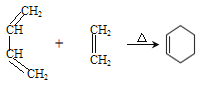
②RMgBr RCH2CH2OH+
RCH2CH2OH+![]()
③R-CHO![]()
![]()
![]()
![]()
完成下列填空:
(1)A的分子式为C3H4O,其结构简式为____________。
(2)E→F的化学方程式为____________。
(3)H的结构简式为_________________。写出满足下列条件的苯丙氨酸同分异构体的结构简______________、________________。
I.含有苯环;II.分子中有三种不同环境的氢原子。
(4)结合题中相关信息,设计一条由CH2Cl2和环氧乙烷(![]() )制备1,4-戊二烯的合成路线(无机试剂任选)。___________。(合成路线常用的表示方式为:A
)制备1,4-戊二烯的合成路线(无机试剂任选)。___________。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol·L-1的Na2CO3溶液中含有CO32-的数目一定小于0.1NA
B.用惰性电极电解CuSO4溶液时,阳极产生1.12L(标准状况)气体,则电路中通过的电子数为0.2NA
C.将0.1 molHI完全溶解于1L水中,则溶液中氢原子数为0.1NA
D.一定条件下,某密闭容器中发生反应:N(g)+3H2(g) ![]() 2NH3(g)。该条件下,投入1molN2和3molH2,反应达到平衡时,转移的电子数为6NA
2NH3(g)。该条件下,投入1molN2和3molH2,反应达到平衡时,转移的电子数为6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是一种重要的化工原料。接触法生产的硫酸产品有98%的硫酸、20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为0.2)。
完成下列计算:
(1)若不计生产过程的损耗,__________m3 SO2(折合成标准状况)经充分转化、吸收,可产出1吨 98%的硫酸(密度为1.84g/mL)。若98%的硫酸可表示为SO3![]() H2O,20%的发烟硫酸可表示为SO3aH2O,则a的值为 ___________(用分数表示)。
H2O,20%的发烟硫酸可表示为SO3aH2O,则a的值为 ___________(用分数表示)。
(2)铝和铝的化合物在社会生产和人类生活中也有着重要的作用。现有甲、乙两瓶无色溶液,已知它们可能是Na[Al(OH)4]溶液和H2SO4溶液。现经实验获得如下数据:
(已知:2Na[Al(OH)4]+H2SO4→2Al(OH)3↓+Na2SO4+2H2O)
组别 | 甲(mL) | 乙(mL) | 沉淀的物质的量(mol) |
① | 140 | 10 | 0.02 |
② | 10 | 140 | 0.02 |
③ | 20 | 560 | 0.04 |
请通过必要的计算推断过程回答:乙溶液中的溶质是什么________?其物质的量浓度为多少________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com