
科目: 来源: 题型:
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
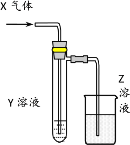
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】《Inorganic Syntheses》(无机合成)一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。

该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
A.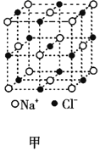 在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B.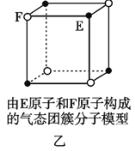 该气态团簇分子(图乙)的分子式为EF或FE
该气态团簇分子(图乙)的分子式为EF或FE
C.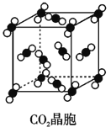 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.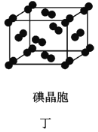 在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260 g草酸晶体,配成100 mL溶液。
②取25.00 mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000 mol/L的KMnO4溶液滴定H2C2O4溶液,当__________________时,滴定结束。
④记录数据,重复实验。整理数据如:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 11.50 |
回答下列问题:
(1)步骤①需使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为______________(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为_______________(填名称)。
(2)该反应原理的化学方程式为_____________________________________________。
(3)请将步骤③补充完整_____________________________________________________。
(4)根据数据,计算H2C2O4溶液的物质的量浓度为_________mol/L,x=________。
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会_________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
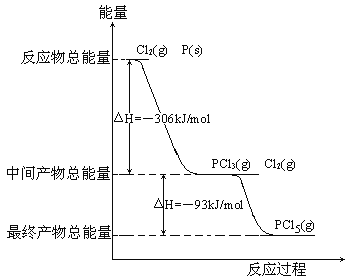
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对如图装置(铁的防护)的分析正确的是( )
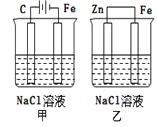
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】勒夏特列原理是自然界一条重要的基本原理,下列事实能用勒夏特列原理解释的是
A. NO2气体受压缩后,颜色先变深后变浅
B. 对2HI(g) ![]() H2(g)+I2(g)平衡体系加压,颜色迅速变深
H2(g)+I2(g)平衡体系加压,颜色迅速变深
C. 合成氨工业采用高温、高压工艺提高氨的产率
D. 配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知![]() 的相对原子质量为34.969,下列相关说法正确的是( )
的相对原子质量为34.969,下列相关说法正确的是( )
A.氯元素的近似相对原子质量为35
B.氯元素的某种同位素的质量数为35
C.氯元素的中子数为18
D.氯原子的质量为34.969
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com