
科目: 来源: 题型:
【题目】在一定条件下,密闭容器中进行反应CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

A. p1>p2
B. ΔH<0
C. 加入催化剂可以提高甲烷的转化率
D. 恒温下,缩小容器体积,平衡后CH4浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2 (g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到平衡后,若扩大容器体积,则平衡逆向移动
B.若单位时间内生成x mol NO,同时消耗x mol NH3,则达到平衡状态
C.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】图A装置常用于实验室制备气体
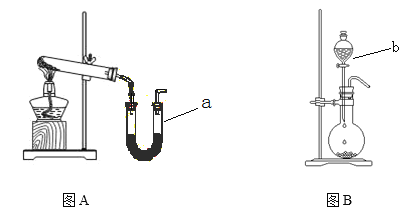
(1)写出实验室用该装置制备O2化学方程式 __________________________________。
(2)若利用该装置制备干燥NH3,试管中放置药品是_______________(填化学式);仪器 a中放置药品名称是________ 。
(3)图B装置实验室可用于制备常见的有机气体是_______。仪器b名称是_________。有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因 。______________________________________________________________
(4)学生甲按图所示探究氨催化氧化
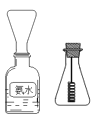
①用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气 ,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色。下列叙述正确的是_________
A.如图收集氨气是利用氨水的密度较小 B.锥形瓶必须干燥
C.收集氨气时间越长,红棕色现象越明显 D.铜丝能保持红热
②学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确。_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)![]() H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
A.加入H2O(g),平衡向正反应方向移动,体系压强减小
B.加入CO,混合气体的密度增大
C.降低温度,平衡向正反应方向移动
D.加入少量C,正反应速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10min时,平均反应速率υ(NO2) = ____________________ ,电子转移了 ___________ 个。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是____________。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2)正 = 7v(N2)逆
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_________ (填增大、不变、减小),NO2的转化率 ______________。
(4)一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
a.一定向正反应方向移动 b. 平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 对2NO2(g)![]() N2O4(g) △H<0, 升高温度平衡体系颜色变深
N2O4(g) △H<0, 升高温度平衡体系颜色变深
D. SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目: 来源: 题型:
【题目】某高分子有机物P的合成路线如下:
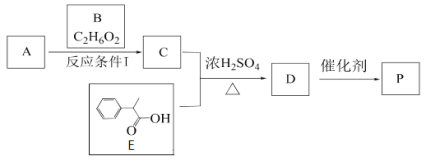
已知1 mol B与足量的金属钠反应产生标况下22.4L氢气
(1)A是2-甲基丙烯酸,A的结构简式是______________,E的化学式为___________________
(2)A和B生成C的反应类型是________,D生成P的反应类型是______________
(3)A与过量的B反应生成C,若A过量,则得到C′, C′的结构简式为__________________
(4)P用NaOH溶液处理,完全水解的化学方程式是:_________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com