
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是
A. C1∶C2=1∶3 B. 平衡时,Y和Z的生成速率之比为3∶2
C. X、Y的转化率不相等 D. C1的取值范围为0<C1<0.14 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一种塑料抗氧化剂C可通过下列反应合成:
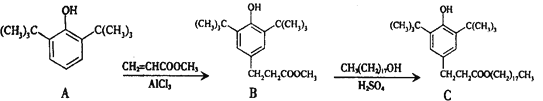
下列有关叙述正确的是
A.物质A是苯甲醇的同系物
B.物质B能发生取代、加聚等反应
C.可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质
D.1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列物质变化,所得能量变化关系正确的是
物质变化 | 能量关系 | |
A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
B | 将NaOH溶液与HCl溶液混合 |
|
C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
D | 合成氨:N2(g)+3H2(g) | 反应物的总键能>生成物的总键能 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图。下列有关说法错误的是
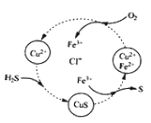
A.氢、氯、铜三元素的化合价未发生改变
B.转化过程中包含三步化学反应
C.转化过程中还原剂为H2S和FeCl2
D.总反应可表示为:2H2S+O2→ 2S+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ).

A.△H1 >△H2 △H2<△H3
B.反应HCO3-(aq)+H+(aq)=CO2 (g)+H2O(l)为放热反应
C.H2CO3(aq)= CO2(g)+H2O(l),若使用催化剂,则△H3变小
D.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
查看答案和解析>>
科目: 来源: 题型:
【题目】环己酮是工业上主要用作有机合成的原料溶剂,可由最简单芳香烃A经如图流程制得:
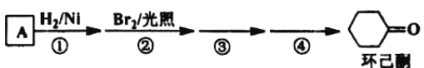
回答下列问题:
(1)反应①的反应类型为___反应,③的反应类型为___。
(2)反应④所用的试剂为___。
(3)A的同系物(C8H10)所有可能的结构简式为___。
(4)环己酮的还原产物能与乙酸产生乙酸乙酯,请写出产生酯的条件:___。
(5)写出A的相邻同系物合成![]() 的合成路线___。
的合成路线___。
合成路线的常用表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目: 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+CO2↑
2Na2SiO3+CaSiO3+CO2↑
(1)某反应物在熔融状态下不导电,它属于___晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为___。
(3)碳和硅属于同族元素,该族元素的原子最外层轨道表示式为___。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:___。
(5)CO2的电子式为___。
(6)反应物Na2CO3和CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,工业制备硫酸的接触室中二氧化硫不能完全转化为三氧化硫,尾气必须处理。某兴趣小组模拟接触室中反应,如图是分别在三种不同实验条件下进行反应,反应物二氧化硫的浓度随时间的变化。
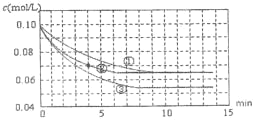
(1)工业制硫酸的接触室中用二氧化硫与氧气制三氧化硫的生产条件为_______。
(2)实验②,0~4min 平均反应速率v(O2)=______。
(3)实验③可能改变的条件是什么:______请简述理由。______(已知正反应放热)
(4)二氧化硫尾气可以用氨水吸收,最终的产物可能有(NH4)2SO4、(NH4)2SO3、NH4HSO3。若三者的物质的量浓度相同时,铵根离子浓度由大到小的顺序为______。
(5)浓硫酸是常见的干燥剂,请解释不能干燥硫化氢与氨气的原因_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。
(1)饱和食盐水所用的原料粗盐主要来自于海洋,从海水中得到粗盐我们通常用的方法是_______。
(2)所得的粗盐(含Ca2+、Mg2+、SO42-)需要提纯,需要加入足量NaOH、BaCl2、Na2CO3溶液将杂质离子除去,随后过滤并加入盐酸调pH至7。其中先用BaCl2,再用Na2CO3的原因是______。
(3)饱和食盐水除用于制纯碱,也是氯碱工业的原料。氯碱工业中电解饱和食盐水的方程式为_______。
(4)测试纯碱产品中NaHCO3含量的方法是:用_______(定量仪器)称取纯碱样品1.144g,用蒸馏水溶解,加入0.500mol/L的HCl溶液100mL,再加1-2滴酚酞,继续用0.500mol/L标准氢氧化钠溶液滴定。当滴定至溶液由_____色变_____色,半分钟不变色为滴定终点。
(5)若上述过程中共消耗氢氧化钠58.00mL,纯碱样品中NaHCO3质量分数为_____。(保留3位小数)
(6)如果装氢氧化钠的滴定管滴定结束读数时有漏液情况,会导致测定结果______(选填“偏大”、“偏 小”、“不受影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com